Микромир атомов - загадочная и удивительная область науки, которая погружает нас в мир невидимых и сложных составляющих материи. Как понять, что находится внутри атома, если мы не можем увидеть его непосредственно? Ответ на этот вопрос лежит в электронной формуле атома - инструменте, позволяющем понять его строение и объяснить разнообразные свойства и взаимодействия. В этом разделе мы погрузимся в увлекательный мир электронных оболочек, систематических правил и уникальных принципов, которые определяют поведение атомов и молекул.
Наше стремление познать и понять устройство атома началось задолго до появления электронной формулы. Пространство микромира было исследовано множеством ученых, каждый из которых вносил свой вклад в расширение нашего понимания. Наблюдения, эксперименты и размышления привели к открытию ряда закономерностей и систематических паттернов. Это позволило создать обобщенную модель, представляющую атом в виде ядра, окруженного оболочками, в которых расположены электроны. Развитию этой модели предшествовали многие этапы, и именно электронная формула помогла закрепить полученные знания и объяснить множество физических и химических явлений.
Электронная формула атома является компактным и информативным способом представления его электронной конфигурации. Она показывает, какие электроны находятся внутри каждой оболочки и как они распределены между ними. Как карта, которая помогает ориентироваться в пространстве, электронная формула помогает нам лучше понять и предсказать свойства и химическую активность атомов и молекул. В этом разделе мы рассмотрим ключевые концепции электронной формулы, проанализируем ее построение и важность для практического применения в химических исследованиях и технологиях.
Значение и необходимость электронных обозначений атомов

Значение электронных обозначений атомов заключается в том, что они помогают нам увидеть и понять внутреннюю структуру атомов. Эти обозначения дают нам возможность представить себе расположение и движение электронов вокруг ядра атома, а также указывают на их энергетические состояния. Благодаря этой информации, мы можем делать предсказания о поведении атомов в реакциях, понимать причины определенных свойств элементов и использовать эту информацию при синтезе новых материалов и соединений.
Необходимость электронных обозначений атомов обусловлена тем, что они помогают нам классифицировать элементы и устанавливать их связи с другими элементами. Зная электронную конфигурацию атома, мы можем определить его положение в периодической таблице химических элементов, причем, это положение не только указывает на физические свойства элемента, но и предсказывает его химическую и реакционную активность. Эти обозначения позволяют нам также увидеть, какие элементы окажутся устойчивыми в связях и какие будут обладать химической активностью, что играет важную роль не только в науке, но и в промышленности, медицине и множестве других областей нашей жизни.
Вся эта информация, описанная электронными обозначениями атомов, помогает нам углубить наше понимание мира, позволяя нам не только изучать его, но и использовать исследования для создания новых веществ и прогресса в различных научных и промышленных областях.
Ключевые аспекты понятия "Структура электронов в атоме"

При рассмотрении структуры электронов в атоме, важно обратить внимание на ряд основных аспектов, которые определяют его электронную конфигурацию и свойства. Понимание этих аспектов позволяет установить, как электроны распределены вокруг атомного ядра и как они взаимодействуют друг с другом.
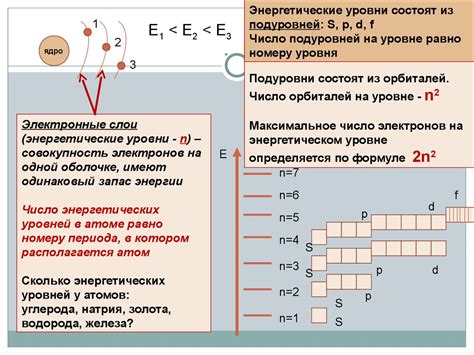
- Энергетические уровни и субуровни
- Квантовые числа
- Принципы размещения электронов и заполнения оболочек
- Спин электронов и правило Паули
Понятие электронной структуры атома является ключевым для понимания его химических свойств и реактивности. Она определяет орбитали, на которые могут располагаться электроны, и их заполнение, что влияет на взаимодействия атомов в химических соединениях.
Важно отметить, что электронная структура атома можно определить с использованием различных моделей, таких как модель Шрёдингера и теория валентной связи. Однако, независимо от используемой модели, понимание электронной структуры атома открывает двери к пониманию его свойств и реактивности, а также обеспечивает основу для дальнейшего изучения химии.
Важность электронной структуры атома в научной области химических исследований

Одной из важных причин, по которой электронная структура атома занимает центральное место в химии, является то, что она позволяет предсказывать и объяснять свойства химических соединений. Зная расположение электронов и их энергетические уровни, мы можем анализировать, как атом будет взаимодействовать с другими атомами для образования связей и формирования молекул.
Кроме того, электронная структура атома играет важную роль в определении энергетических свойств и устойчивости материалов. Например, зная электронную структуру атомов в кристаллической решетке, мы можем оценить их теплопроводность, электропроводность и оптические свойства.
Электронная структура атома также является основой для понимания реакций и механизмов химических процессов. Зная, как электроны перераспределяются во время реакции, мы можем понять, как происходит образование и разрушение химических связей. Это знание имеет ключевое значение при разработке новых лекарственных препаратов, материалов и технологий.
- Предсказывание и объяснение свойств химических соединений
- Определение энергетических свойств и устойчивости материалов
- Понимание реакций и механизмов химических процессов
Примеры электронных образов атомов
В этом разделе мы рассмотрим несколько примеров, иллюстрирующих уникальные электронные образы атомов. Они представляют собой уникальные конфигурации электронов, которые определяют химические и физические свойства каждого элемента.
Первым примером является кислород, обладающий атомным номером 8. В его электронном образе присутствуют две электронные оболочки. На внешней оболочке находятся 6 электронов, что делает его атом стабильным и химически активным. Благодаря этому свойству, кислород играет важную роль в органической химии, участвуя во многих химических реакциях.
Другим примером может быть натрий с атомным номером 11. Этот металл обладает одной внешней электронной оболочкой, содержащей всего один электрон. Именно это электронное строение делает натрий химически активным металлом. Он легко реагирует с водой и воздухом, образуя различные химические соединения.
Как мы видим, электронная структура атомов определяет их химические свойства и способность участвовать в реакциях. Изучение электронных образов атомов играет ключевую роль в понимании многих химических процессов и является основой для разработки новых материалов и технологий.
Электронная схема атома кислорода: структура и особенности

Атом кислорода имеет 8 электронов, распределенных на разных энергетических уровнях. Эти электроны изолированы в различные области, называемые электронными оболочками. Внешняя электронная оболочка кислорода содержит 6 электронов, что делает его атом очень реакционноспособным.
Основываясь на принципе заполнения электронных оболочек, электронная схема атома кислорода может быть представлена следующим образом:
1s2 2s2 2p4
Где "1s" и "2s" - обозначают первые два энергетические уровни, а "2p" - обозначает третий энергетический уровень. Числа и буквы после энергетических уровней указывают на количество электронов в соответствующих областях.
Электронная схема атома кислорода позволяет понять его химические свойства. В сочетании с другими элементами, кислород может образовывать различные соединения, такие как оксиды и кислородсодержащие органические соединения. Это делает кислород одним из ключевых игроков в химических процессах и жизни в целом.
Структура атома углерода: расположение электронов и способы представления
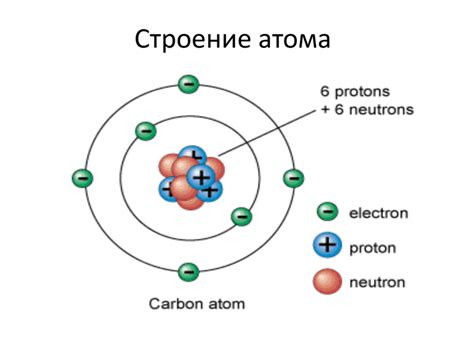
Атом углерода состоит из ядра, в котором находятся протоны и нейтроны, а также облака электронов, вращающихся вокруг ядра на различных энергетических уровнях. Число электронов в атоме углерода равно атомному номеру элемента, а именно 6. Распределение этих электронов в атоме углерода подчиняется определенным правилам и представляется в виде электронной формулы.
Существует несколько способов представления электронной формулы атома углерода. Один из самых простых и распространенных - запись электронной формулы в виде символов, обозначающих энергетические уровни и количество электронов на каждом из них. Например, электронная формула атома углерода может быть записана следующим образом: 1s^2 2s^2 2p^2, где цифры обозначают энергетические уровни, а буквы и индексы - подуровни и количество электронов.
Другим способом представления электронной формулы атома углерода является использование схемы Льюиса. В этом случае, наряду с энергетическими уровнями и подуровнями, визуально отображаются также отдельные электроны. Схема Льюиса атома углерода показывает четыре электрона на внешнем энергетическом уровне, что является ключевым фактором для его реакционной активности.
Вопрос-ответ

Что такое электронная формула атома?
Электронная формула атома это графическое изображение расположения электронов в атоме. Она позволяет представить наличие электронов в различных энергетических оболочках и подобрать химические формулы для атомов и ионов.
Какие обозначения применяются в электронных формулах атомов?
В электронных формулах атомов применяются следующие обозначения: буква элемента, указывающая на его символ, числа, обозначающие количество электронов в каждой энергетической оболочке, и штрихи, обозначающие спаренные электроны.
Для чего необходимо знать электронную формулу атома?
Знание электронной формулы атома позволяет предсказывать его химическое поведение, а также строить химические формулы соединений. Также это помогает понять строение вещества и его свойства.
Каким образом можно представить электронную формулу атома?
Электронную формулу атома можно представить в виде нотации, где каждая энергетическая оболочка обозначается числом, а количество электронов в каждой оболочке отображается с помощью точек или штрихов. Также можно использовать электронные конфигурации для более подробного описания электронного строения атома.



