Мир вокруг нас, на первый взгляд, кажется простым и однообразным. Однако, при более внимательном рассмотрении становится понятно, что вещества, которые нас окружают, обладают непостижимой сложностью и рядом удивительных свойств. О Гола слышал и смотрел все, и уж истиннее нути про то с научным определением говорить - рабунов много. Но суть все в том, что основные строительные блоки вещества - это молекулы.
Молекулы - это непревзойденные архитекторы микромира, которые, собираясь вместе, создают все, что нас окружает. Основными элементами, из которых состоят молекулы, являются атомы. Атомы, в свою очередь, обладают своей уникальной структурой и обеспечивают стойкость и взаимодействие молекул. Как показывает практика, даже одноатомные вещества, хоть и состоят из одного атома, но все же образуют молекулы. Причем, это не просто скопление атомов в пространстве, а уникальная структура, определяющая свойства и особенности каждого вещества. Именно молекулярная структура позволяет нам различать разные вещества и их свойства.
Понять, что вещество состоит из молекул, помогает наблюдение за изменениями в поведении вещества при изменении условий – температуры, давления, смешивания с другими веществами. Экспериментальные данные позволяют установить закономерности взаимодействия молекул и предугадать, как вещество будет себя вести в различных условиях. Это основа для создания новых материалов и веществ, а также для построения теорий и моделей, объясняющих мир в масштабах невидимого микромира.
Система молекулярного строения: определение и примеры

В основе молекулярного строения лежит концепция представления вещества как совокупности молекул, которые образуют устойчивые и стабильные структуры. Молекулы состоят из атомов, которые связаны между собой с помощью химических связей. Образование и разрыв химических связей приводит к возникновению различных химических реакций и изменению свойств вещества.
Примером молекулярного строения является вода (H2O). В молекуле воды два атома водорода (H) связаны с одним атомом кислорода (O) с помощью ковалентных связей. Такая структура обеспечивает устойчивость молекулы воды и ее характерные физические и химические свойства, такие как кипение при 100°C и образование водородных связей между смежными молекулами.
Еще одним примером молекулярного строения является этилен (C2H4). В молекуле этилена два атома углерода (C) связаны между собой двойной связью, а к ним присоединены по два атома водорода (H). Такая структура обусловливает химическую активность этилена и его способность реагировать с другими веществами, что позволяет использовать его в промышленности при производстве пластмасс и синтезе органических соединений.
Молекулярная структура: понятие и характеристики

Молекулы – это элементарные частицы, образующие вещество. Они состоят из атомов, соединенных химическими связями. Молекулярная структура определяется порядком и способом соединения атомов, и именно эти факторы влияют на свойства вещества, такие как температура плавления и кипения, плотность, растворимость, химическая активность и многое другое.
Один из ключевых вопросов, изучаемых в данном разделе, – каким образом выстроена молекулярная структура? Здесь рассматриваются различные модели и теории, позволяющие описать пространственное расположение атомов в молекуле: от простых одномерных цепочек до сложных трехмерных структур. Кроме того, изучение молекулярной структуры помогает узнать о наличии изомерии – явлении, когда разные молекулы состоят из одних и тех же атомов, но различаются по пространственной конфигурации связей.
Как следствие, понимание молекулярной структуры играет важную роль в различных научных областях, таких как химия, биология и физика. Оно позволяет предсказывать свойства и поведение веществ, создавать новые материалы с нужными характеристиками и разрабатывать лекарства на основе структуры молекул.
Связи между атомами: ковалентные, ионные и водородные связи

В данном разделе мы рассмотрим различные типы связей между атомами в веществах. Обратим внимание на ковалентные, ионные и водородные связи, которые важны для понимания структуры и свойств различных веществ.
| Тип связи | Образование | Свойства | Примеры |
|---|---|---|---|
| Ковалентные связи | Образуются, когда атомы делят одну или более пар электронов | Обычно прочные и не проводят ток; могут быть полярными или неполярными | Молекулы воды (H2O), метана (CH4), кислорода (O2) |
| Ионные связи | Образуются, когда атомы обменивают или передают электроны друг другу | Обычно твердые и хрупкие со свойствами проводить ток в расплавленном или растворенном состоянии | Хлорид натрия (NaCl), оксид кальция (CaO), карбонат лития (Li2CO3) |
| Водородные связи | Образуются между атомом водорода и электроотрицательным атомом некоторого другого вещества | Относительно слабые связи, которые могут приводить к образованию кластеров и специфическим свойствам | Водные молекулы между собой, молекулы ДНК и белков |
Кристаллическая и аморфная структура: особенности и примеры

Многие вещества в нашей окружающей среде обладают определенной структурой, которая может быть кристаллической или аморфной. Структура вещества играет важную роль в его свойствах и характеристиках. Кристаллическая структура представляет собой упорядоченную решетку, где атомы, ионы или молекулы расположены по строго определенным правилам и имеют регулярное повторяющееся расположение. В свою очередь, аморфная структура отличается отсутствием такого упорядочения и хаотичным размещением частиц вещества.
Основным отличием между кристаллической и аморфной структурой является наличие или отсутствие длиннодальнего порядка. В кристаллической структуре каждая частица занимает определенное место в решетке и ее положение может быть точно определено. В аморфной структуре, наоборот, частицы расположены более хаотично и их положение нельзя однозначно описать. В результате, вещества с кристаллической структурой обычно обладают более высокой упругостью и твердостью по сравнению с веществами с аморфной структурой.
Примером вещества с кристаллической структурой является диоксид кремния (SiO2), известный как кварц. Силикаты, такие как гранит, также обладают кристаллической структурой. С другой стороны, аморфная структура наблюдается в стекле, пластике, аморфном кремнии и жидком состоянии многих веществ.
| Кристаллическая структура | Аморфная структура |
|---|---|
| Упорядоченная решетка | Хаотичное размещение частиц |
| Высокая упругость и твердость | Низкая упругость и твердость |
| Пример: кварц, гранит | Пример: стекло, пластик |
Понимание различий между кристаллической и аморфной структурой веществ позволяет лучше понять их свойства и использование в различных областях науки и технологий.
Объединение молекул: макромолекулы и полимеры
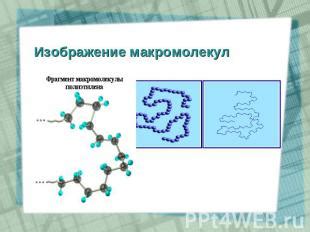
Макромолекулы - это большие и сложные соединения, образованные из множества молекул, связанных друг с другом. В процессе образования макромолекул происходит полимеризация - химическая реакция, при которой молекулы соединяются в длинные цепочки или сети. Полимеры являются одним из типов макромолекул, их особенностью является повторение одного или нескольких одинаковых структурных элементов (мономеров) в длинной цепочке.
Макромолекулы и полимеры имеют широкий спектр применения в различных областях, таких как промышленность, медицина и электроника. Пластичность, прочность и устойчивость к воздействию различных сред - основные свойства полимеров, делающие их незаменимыми материалами.
Узнать больше о свойствах и классификации макромолекул и полимеров.
Анализ структуры вещества: роль спектроскопии и рентгеноструктурного анализа

Спектроскопия позволяет исследовать вещество, определяя взаимодействие с электромагнитным излучением разных частот и диапазонов. Этот подход основан на способности молекулы поглощать, испускать или рассеивать свет определенных длин волн, что позволяет определить ее состав и свойства. В зависимости от спектрального диапазона, используемого в спектроскопии, можно получить информацию о различных аспектах молекулярного строения, таких как связи между атомами, ориентацию молекул в пространстве и их конформационные состояния.
Рентгеноструктурный анализ, с другой стороны, основан на рассеянии рентгеновских лучей на атомах, из которых состоит вещество. Благодаря использованию дифракции рентгеновского излучения на кристаллическом образце, возможно определить расположение атомов в пространстве и определить структуру кристалла. По сути, этот метод позволяет создать "отпечаток" молекулярной сетки и определить расстояния и углы между атомами с высокой точностью.
Использование спектроскопии и рентгеноструктурного анализа в комбинации с другими методами позволяет получить всестороннюю информацию о молекулярной структуре вещества. Это позволяет исследовать свойства материалов, разрабатывать новые препараты в фармацевтической промышленности, оптимизировать процессы производства и проектирования новых материалов в химической и материаловедении, а также расширять понимание фундаментальных принципов химии и физики.
Разнообразие агрегатных состояний веществ: от газообразного состояния до твердых тел
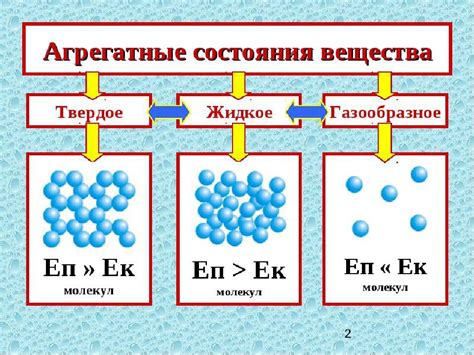
Интересно и удивительно, какие разнообразные формы и состояния могут принимать вещества! Они могут быть газами, жидкостями и твердыми телами, каждое из которых обладает своими характерными свойствами и структурой. Понимание этих агрегатных состояний открывает перед нами мир удивительных явлений и процессов, происходящих в нашей окружающей среде.
Газообразное состояние отличается низкой плотностью и превосходной подвижностью молекул, которые находятся в постоянном хаотическом движении. От синих голубей земного неба до непрозрачного дыма от домашнего камина, газы окружают нас в повседневной жизни и играют важную роль в различных физических и химических процессах.
Жидкое состояние характеризуется более высокой плотностью и вязкостью молекул, которые могут свободно перемещаться, но не так быстро, как в газообразном состоянии. Это состояние вещества мы часто встречаем в повседневной жизни: вода, масло, соки, кровь и многое другое - все это жидкости, которые обладают свойством принимать любую форму сосуда, в котором они находятся.
Твердые тела, в свою очередь, имеют наибольшую плотность и фиксированную структуру молекул. Их атомы или молекулы встраиваются в упорядоченные кристаллические решетки, что делает твердые тела прочными и несжимаемыми. Имея различные формы и свойства, от прозрачных кристаллов до твердых, плотных металлов, твердые вещества широко применяются в технологии и строительстве.
Вот такое удивительное разнообразие состояний веществ помогает нам понять, как молекулы объединяются и взаимодействуют друг с другом, создавая невероятные явления исследования которых зачастую вызывает у нас ощущение неодолимого восторга и увлечения.
Структура и свойства кристаллических твердых веществ

Одна из ключевых характеристик кристаллических твердых веществ - их кристаллическая решетка. Кристаллическая решетка определяется упорядоченным пространственным расположением атомов, ионов или молекул вещества. Эта решеточная структура обеспечивает определенные свойства твердых веществ, такие как их прочность, жесткость и плотность.
| Свойства | Описание |
|---|---|
| Симметрия | Кристаллические твердые вещества обладают определенной симметрией, которая проявляется в их повторяющейся решеточной структуре. |
| Изотропность | Некоторые кристаллические твердые вещества являются изотропными, что означает, что их свойства не зависят от направления. |
| Регулярное расположение | Атомы, ионы или молекулы в кристаллических твердых веществах расположены в регулярной (упорядоченной) структуре, что обуславливает их уникальные свойства и форму. |
| Отсутствие просчетов | Решеточная структура кристаллических твердых веществ обеспечивает сохранение пространственного порядка, что приводит к отсутствию просчетов. |
Изучение структуры и свойств кристаллических твердых веществ имеет важное значение в различных областях науки и технологии, включая материаловедение, химию и физику. Понимание устройства кристаллической решетки позволяет предсказывать и объяснять множество свойств и поведение твердых веществ, что может привести к разработке новых материалов с улучшенными свойствами и функциональностью.
Роль молекулярного строения в химических реакциях

Молекулярное строение веществ играет важную роль в процессах химических реакций. Понимание того, как молекулы устроены и взаимодействуют друг с другом, позволяет объяснить различные явления и превращения, происходящие при химических реакциях.
Каждое вещество состоит из минимальных частиц - молекул. Молекула представляет собой группу атомов, связанных между собой. В химических реакциях происходят изменения молекулярного строения, при которых атомы переходят из одних соединений в другие, образуя новые молекулы.
Молекулярное строение определяет не только химические свойства вещества, но и его физические свойства, такие как плотность, температура плавления и кипения, растворимость и др. Кроме того, молекулярное строение влияет на скорость и эффективность химических реакций.
В химических реакциях молекулы веществ могут разрываться или образовываться новые связи между атомами. Эти процессы зависят от энергии, необходимой для преодоления энергетических барьеров. Молекулярное строение обуславливает степень стабильности молекулы и реакционной среды, что влияет на возможность и скорость протекания реакции.
Исследование молекулярного строения веществ позволяет углубленно изучать и понимать механизмы химических реакций, прогнозировать и контролировать их результаты. Понимание роли молекулярного строения является одним из ключевых аспектов химической науки и применяется в различных областях, включая фармацевтику, материаловедение, пищевую промышленность и многое другое.
Вопрос-ответ

Как можно определить, состоит ли вещество из молекул?
Существует несколько методов, позволяющих определить, состоит ли вещество из молекул. Один из таких методов - это изучение структуры вещества с помощью рентгеновского или электронного микроскопа. Если удаётся увидеть вещество в виде отдельных частиц, то можно заключить, что они представляют собой молекулы. Другим методом является использование спектрального анализа, при котором изучаются поглощение или испускание света веществом. Если наблюдается дискретный спектр, это указывает на наличие молекул. Также, можно применить методы химического анализа для выявления характеристик молекулярной структуры вещества.
Какие свойства обуславливают наличие молекул в веществе?
Наличие молекул в веществе обусловлено несколькими свойствами. Во-первых, молекулы имеют конечный размер, что значит, что вещество можно рассматривать как совокупность отдельных частиц. Во-вторых, молекулы могут существовать в состоянии свободного перемещения, то есть они обладают движением. В-третьих, молекулы взаимодействуют друг с другом с помощью сил притяжения или отталкивания, что позволяет им образовывать различные структуры и макромолекулы. Все эти свойства характерны для веществ, состоящих из молекул.



