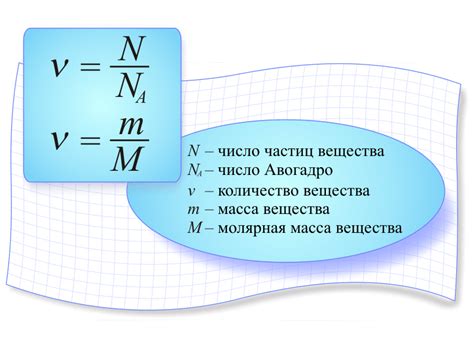
Наука химия изучает различные вещества и их свойства, помогая нам лучше понять окружающий нас мир. Одна из важных характеристик вещества - его молярная масса. Это показатель, который помогает нам определить количественное соотношение между атомами и молекулами вещества.
Определение молярной массы не только позволяет нам лучше понять структуру вещества, но и играет ключевую роль в решении ряда практических задач. Например, в химических реакциях мы работаем с определенными количествами веществ, и знание их молярных масс позволяет нам правильно рассчитывать количество вещества, используемого или образующегося в химической реакции.
Вычисление молярной массы включает в себя использование различных методов и формул. Одними из наиболее распространенных методов являются использование таблицы химических элементов и учет количества атомов каждого элемента в молекуле вещества. Это позволяет нам определить количественное соотношение между атомами и молекулами и вычислить молярную массу.
Введение в понятие молярной массы и его значимость в химии

Основной принцип определения молярной массы заключается в учете атомных масс элементов и их количества в молекуле или формуле вещества. Отличие между атомной массой и молярной массой состоит в том, что атомная масса указывает на массу единичного атома, а молярная масса выражается в граммах и относится к молям вещества.
Определение молярной массы является важным шагом при решении задач по химическим расчетам. Зная молярную массу, можно вычислить количество вещества, массу вещества в реакции, а также произвести стехиометрический расчет с учетом пропорций веществ в реакции.
Основные понятия, связанные с молярной массой в химии

| Понятие | Описание | Пример |
|---|---|---|
| Молярная масса | Суммарная масса всех атомов в молекуле вещества, выраженная в граммах. Используется для вычисления количества вещества в химических реакциях. | Молярная масса воды (H₂O) равна приблизительно 18 г/моль. |
| Молярный объем | Объем одного моля газа при стандартных условиях (0°C и 1 атм давления). Используется для расчетов объемных соотношений в химических реакциях. | Молярный объем идеального газа при стандартных условиях равен 22,4 л/моль. |
| Молярная концентрация | Количество вещества, выраженное в молях, разделенное на объем растворителя. Используется для измерения концентрации растворов и определения их состава. | Молярная концентрация раствора NaCl составляет 0,1 моль/литр. |
| Молярное соотношение | Отношение коэффициентов реакции в химическом уравнении, показывающее, сколько молекул каждого реагента участвует в реакции. Используется для расчетов количества реагентов и продуктов в химических реакциях. | Молярное соотношение в реакции C₆H₁₂O₆ + 6O₂ → 6CO₂ + 6H₂O составляет 1:6:6:6. |
Эти понятия являются основой для понимания и применения молярной массы в различных аспектах химии. Наличие глубоких знаний о них позволяет более точно расчеты, анализировать и предсказывать свойства веществ и их составы, а также прогнозировать результаты химических реакций.
Принцип определения массы вещества в химических расчетах
Раздел "Принцип определения массы вещества в химических расчетах" посвящен изучению основных принципов и концепций, которые лежат в основе определения массы вещества в химических реакциях. В данном разделе будет рассмотрено, каким образом можно определить массу вещества, используя различные методы и подходы. Без понимания этой принципиальной составляющей, невозможно провести точные расчеты и аналитические исследования в химической науке. В этом разделе будут рассмотрены основные принципы и примеры практического применения этих принципов в решении различных химических задач.
| Метод | Описание |
|---|---|
| Метод газовых расчетов | Используется для определения молярной массы газовых веществ. Основан на измерении давления, объема и температуры газа. |
| Метод гравиметрического анализа | Основан на определении массы отдельных элементов или соединений с использованием методов, основанных на измерении массы образовавшихся веществ. |
| Метод титрования | Используется для определения концентрации вещества в растворе путем его реакции с известным реагентом. Основан на точном измерении объема реагента, необходимого для полного реагирования с исследуемым веществом. |
Знание принципов вычисления массы вещества является важным инструментом для химиков, позволяющим проводить точные и надежные исследования, а также расчеты в химической науке. Обладая этими знаниями, химики могут предсказывать результаты различных химических реакций, контролировать процессы синтеза и анализа вещества, а также улучшать и оптимизировать химические процессы в различных отраслях промышленности.
Основные правила и примеры вычисления молярной массы элементов

Прежде всего, необходимо определить количество атомов каждого элемента в молекуле вещества, а также их относительные массы. Далее, с помощью таблицы Менделеева можно найти атомную массу каждого элемента. Затем, нужно перемножить количество атомов каждого элемента на их атомную массу и сложить полученные значения. Результатом будет молярная масса вещества, выраженная в граммах на моль.
Рассмотрим пример. Возьмем молекулу воды (H2O). Для расчета молярной массы необходимо учесть, что в молекуле содержатся два атома водорода и один атом кислорода. Коэффициент перед формулой H2O указывает наличие двух атомов водорода.
Атомная масса водорода равна 1 г/моль, а атомная масса кислорода - 16 г/моль. Умножим количество атомов каждого элемента на их атомные массы и сложим полученные значения: (2 * 1 г/моль) + (1 * 16 г/моль) = 18 г/моль. Получаем, что молярная масса воды составляет 18 г/моль.
Таким образом, вычисление молярной массы элементов требует учета количества атомов и их относительных масс, что позволяет определить массу одного моля вещества. Это важное понятие в химии, которое используется при проведении различных расчетов и анализе реакций.
Математические выражения для расчета мольной массы элемента

Определение мольной массы элемента
При изучении химии одним из ключевых понятий является мольная масса элемента, которая позволяет определить массу одной молекулы или атома. Расчет мольной массы осуществляется на основе математических формул, которые описывают связь между массой, количеством вещества и числом атомов.
Атомная масса и молярная масса
Для определения мольной массы элемента необходимо учитывать его атомную массу, которая указывает на массу одного атома данного элемента. Атомная масса выражается в атомных единицах или Далитонах.
Молярная масса элемента представляет собой сумму атомных масс всех атомов в молекуле этого элемента. Она измеряется в г/моль и позволяет установить массу одной молекулы данного вещества.
Формулы для расчета мольной массы
Существуют различные математические выражения для определения мольной массы элемента в различных соединениях. Некоторые из них включают учет количества атомов каждого элемента в молекуле, а другие основаны на учете массы атомов с использованием периодической таблицы.
Одной из самых простых формул для расчета мольной массы является суммирование атомных масс всех атомов в молекуле.
Также можно использовать формулу, основанную на количестве атомов каждого элемента в молекуле, умноженного на их атомные массы, и затем сложить полученные значения для всех элементов.
Применение математических формул
Правильное использование математических формул для расчета мольной массы элемента позволяет определить массу вещества в экспериментах, а также провести анализ химических реакций и синтеза веществ.
Наличие понимания и умения применять эти формулы является важным навыком для успешного изучения химии и развития в области научных исследований.
Молярные массы различных элементов: практические примеры
В данном разделе представлены практические примеры вычисления молярных масс различных элементов, которые играют важную роль в химических расчетах. Такие расчеты позволяют определить массу одного моля вещества, что дает возможность проводить различные химические преобразования по заданным количествам вещества.
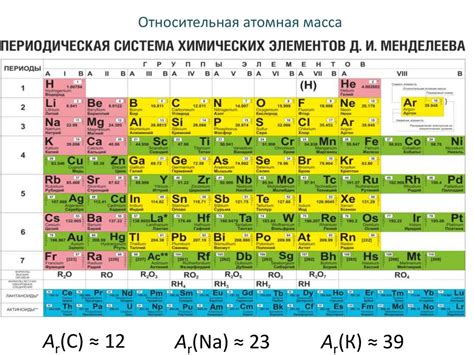
Для примера, рассмотрим расчет молярной массы кислорода - одного из наиболее распространенных и важных элементов в химии. Кислород имеет атомный номер 8 и его атомная масса примерно равна 16, что означает, что один моль кислорода будет иметь массу 16 грамм.
Другим примером является вычисление молярной массы углерода. Углерод имеет атомный номер 6 и атомная масса его изотопов может варьироваться. Самый распространенный изотоп углерода имеет атомную массу около 12,01 грамма на моль. Зная эту массу, можно легко вычислить молярную массу углерода, учитывая его обилие и другие изотопы, которые также существуют в природе.
Также стоит упомянуть о вычислении молярной массы других элементов, таких как водород, азот, натрий и т.д. Каждый элемент имеет свою уникальную атомную массу, которая используется для расчетов в химии.
Расчет молярной массы элементов является важным фактором в различных областях химических исследований и применений, начиная от синтеза новых веществ до анализа состава различных соединений. Использование вычисленной молярной массы элементов помогает в более точных и эффективных химических расчетах и экспериментах.
Методика определения массы атомов в соединениях и их суммарной массы
Одним из основных методов определения массы атомов является использование периодической системы элементов. В периодической системе приведены все известные на данный момент химические элементы, у каждого из которых указана атомная масса. Для расчета молярной массы химического соединения необходимо узнать количество каждого элемента в соединении и умножить его на его атомную массу, после чего все значения суммируются. Таким образом можно получить массу одной молекулы соединения или моль соединения вещества.
| Вещество | Составляющие элементы | Количество каждого элемента в соединении | Атомная масса элемента | Масса элементов в соединении |
|---|---|---|---|---|
| Вода (H2O) | Водород (H), Кислород (O) | 2, 1 | 1.00784 g/mol, 15.999 g/mol | 2.01568 g/mol, 15.999 g/mol |
| Двуокись углерода (CO2) | Углерод (C), Кислород (O) | 1, 2 | 12.011 g/mol, 15.999 g/mol | 12.011 g/mol 31.998 g/mol |
Дополнительным методом определения массы атомов в химических соединениях является использование грамм-формулы. Грамм-формула позволяет определить массовую долю каждого элемента в соединении и применяется, когда известно количество каждого элемента в соединении, но неизвестно его общее количество. Для расчета молярной массы по грамм-формуле необходимо умножить массовую долю каждого элемента на его атомную массу и сложить полученные значения.
Таким образом, существует несколько методов для определения массы атомов в химических соединениях, включая использование периодической системы элементов и грамм-формулы. Знание этих методов позволяет проводить точные расчеты молярной массы и выявлять пропорции элементов в химических соединениях.
Различные методы определения молярной массы химических соединений

- Один из методов основывается на анализе химической формулы соединения. Используя информацию о количестве атомов каждого элемента в формуле, можно вычислить массу каждого атома и затем сложить их для получения общей массы соединения.
- Другой метод основан на использовании данных о процентах составляющих элементов в соединении. Путем перевода процентного содержания в массовые доли и затем вычисления масс каждого элемента, можно определить молярную массу соединения.
- Еще один способ основывается на анализе общего количества вещества и массы соединения. Путем измерения массы и количества вещества можно определить молярную массу, используя известную формулу.
- Некоторые соединения могут быть разложены на их составляющие элементы путем химических реакций. Затем, измерив массу каждого элемента после разложения, можно определить молярную массу соединения.
- Методы масс-спектрометрии также широко применяются для определения молярной массы соединений. Путем анализа спектра масс можно получить информацию о массе каждого изотопа, из которых состоит соединение, и затем суммировать их массы для определения молярной массы.
Каждый из этих способов имеет свои особенности и ограничения, и выбор метода определения молярной массы зависит от конкретной ситуации и доступных средств и оборудования. Понимание различных способов определения молярной массы химических соединений позволяет проводить точные и надежные исследования в области химии и материаловедения.
Практические примеры расчета молярной массы различных соединений

Пример расчета молярной массы можно провести на основе формулы соединения, где каждый элемент имеет свой атомный массовый коэффициент. Рассмотрим, например, простой пример молекулы воды (H2O). Для расчета молярной массы, необходимо учитывать атомные массы всех элементов, в данном случае это водород (H) и кислород (O).
- Атомный массовый коэффициент для водорода (H) равен 1 г/моль.
- Атомный массовый коэффициент для кислорода (O) равен 16 г/моль.
Следовательно, расчет молярной массы воды (H2O) будет выглядеть следующим образом:
- Умножаем атомный массовый коэффициент водорода (H) на его количество в молекуле (2): 1 г/моль * 2 = 2 г/моль.
- Умножаем атомный массовый коэффициент кислорода (O) на его количество в молекуле (1): 16 г/моль * 1 = 16 г/моль.
- Суммируем полученные значения массы: 2 г/моль + 16 г/моль = 18 г/моль.
Таким образом, молярная масса воды (H2O) равна 18 г/моль.
Аналогичным образом можно расчитать молярную массу других соединений, учитывая атомные массы каждого элемента и их количество в молекуле. Расчет молярной массы является важным инструментом, который помогает химикам анализировать и предсказывать поведение различных веществ, а также эффективно проектировать химические реакции и процессы.
Роль молярности в характеристике химических процессов

Масса вещества, выраженная в единицах молярной массы, позволяет установить соотношение между реагирующими веществами и продуктами реакции. Эта информация важна для понимания, какие количества реагентов превращаются в продукты реакции и в каком соотношении. Молярная масса также позволяет вычислить количество вещества в реакции, что позволяет установить его удельную активность и эффективность.
Понимание роли молярной массы в реакциях химических превращений позволяет проводить не только количественный, но и качественный анализ реакций. Например, зная молярную массу вещества, можно определить его сложность или степень окисления. Кроме того, молярная масса позволяет предсказывать результаты реакций на основе знания массового соотношения реагентов и производимых продуктов.
| Аспект | Значение |
|---|---|
| Определение состава | Молярная масса позволяет определить, сколько частиц содержится в данном количестве вещества |
| Предсказание результатов | На основе молярной массы реагентов и продуктов можно предсказать, какие реакции будут протекать |
| Анализ степени окисления | Молярная масса вещества может указывать на сложность и степень окисления |
Роль молярной массы в законе сохранения массы

Молярная масса представляет собой массу одного молярного количества вещества. Она выражается в граммах на моль и является характеристикой каждого конкретного вещества. Понимание значения молярной массы позволяет определить количество вещества на основе массы и наоборот, что важно при выполнении различных химических расчетов и установлении массовых соотношений между реагентами и продуктами.
Применение молярной массы в законе сохранения массы проиллюстрировано через использование формулы реакции и учета стехиометрических коэффициентов. Молярная масса каждого вещества, участвующего в реакции, позволяет определить массу реагентов и продуктов, а также их мольные соотношения. Это позволяет установить, какие вещества будут исчезать, а какие образовываться в реакции, и подтверждает соблюдение закона сохранения массы.
| Термины | Определение |
|---|---|
| Молярная масса | Масса одного молярного количества вещества |
| Закон сохранения массы | Масса реагентов равна массе продуктов в химической реакции |
| Стехиометрический коэффициент | Число в формуле реакции, показывающее соотношение между различными веществами |
Вопрос-ответ

Как вычислить молярную массу химического соединения?
Для вычисления молярной массы химического соединения необходимо сложить массы всех атомов, входящих в его состав. Для этого нужно умножить количество каждого вида атомов в молекуле соединения на их атомные массы, а затем сложить полученные значения.
Какие способы вычисления молярной массы существуют?
Существует несколько способов вычисления молярной массы. Один из них - это использование таблиц атомных масс элементов. Другой способ - это использование формулы, где молярная масса равна сумме произведений атомных масс каждого элемента на их количество в молекуле. Также можно использовать специальные программы и онлайн-калькуляторы для вычисления молярной массы соединений.
Какие примеры можно привести для вычисления молярной массы?
Для примера рассмотрим вычисление молярной массы воды (H2O). Молярная масса воды равна сумме произведения атомных масс водорода и кислорода на их количество в молекуле. Масса атома водорода равна 1 г/моль, атома кислорода - 16 г/моль. Воды содержит 2 атома водорода и 1 атом кислорода. Следовательно, молярная масса воды равна (2*1) + 16 = 18 г/моль.



