Химия – это наука, которая изучает строение, состав и свойства вещества. В процессе своего развития она открывает перед нами удивительный мир атомов и молекул, где каждая связь имеет свои особенности и значения. Среди разнообразия связей в химии особое внимание уделяется сигма и пи связям, которые играют важную роль в формировании молекулярной структуры и свойств вещества.
Сигма и пи связи – это два фундаментальных понятия в органической и неорганической химии. Они представляют собой различные типы химических связей между атомами и обладают уникальными свойствами. Каждая из этих связей участвует в формировании структуры молекулы и определяет ее химические и физические свойства.
Сигма связь образуется, когда два атома соединяются прямым перекрытием своих орбиталей. Она является наиболее прочной и устойчивой связью в химии. Символ сигма (σ) отражает способность этих атомов образовывать связь – они перекрывают свои орбитали по осям атомного ядра, что обеспечивает максимальное взаимодействие и энергетическую стабильность связи.
Основные понятия сигма и пи связей в химии

Сигма связь - это первичная химическая связь, которая образуется при наложении двух атомных орбиталей друг на друга. Она характеризуется высокой энергией связи и направленностью электронного облака, что обеспечивает прочность и стабильность молекулы.
Пи связь, в свою очередь, возникает при наложении двух параллельных пи-орбиталей атомов. Этот тип связи обладает нижей энергией и вышею подвижностью электронного облака, что придает молекуле гибкость и возможность проводить электрический ток.
Важно отметить, что сигма и пи связи занимают разные геометрические позиции внутри молекулы. Сигма связь локализована вдоль оси между двумя атомами, в то время как пи связь располагается над и под плоскостью, проходящей через эти атомы.
| Сигма связь | Пи связь |
|---|---|
| Высокая энергия связи | Низкая энергия связи |
| Направленность электронного облака | Подвижность электронного облака |
| Локализована вдоль оси между атомами | Располагается над и под плоскостью |
Что такое сигма и пи связи?

Сигма связь является самой простой и наиболее распространенной формой связи в химии. Она образуется при перекрытии и перекрытии двух атомных орбиталей, создавая общий объем, который содержит пару электронов. Сигма связь обладает сильным симметричным распределением электронной плотности, что делает ее чрезвычайно стабильной.
Пи связь, с другой стороны, является более сложной формой связи. Она образуется при перекрытии и перекрытии двух атомных орбиталей, но в отличие от сигма связи, она создает область повышенной электронной плотности над и под плоскостью ядер. Это приводит к образованию электронных облаков, названных пи-электронными облаками, которые вносят вклад в химическую активность и реакционную способность молекулы.
Сигма и пи связи вместе обеспечивают структуру и стабильность молекул, а также определяют их реакционные свойства. Понимание этих типов связей является важным для понимания химии и ее приложений в различных областях науки и технологии.
Особенности структуры сигма и пи связей
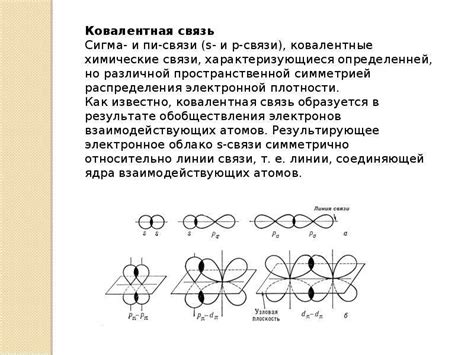
Сигма связь представляет собой направленное сопряжение атомов через область наибольшей плотности электронной области между ними. Эта связь является самой прочной и стабильной, именно она обеспечивает надежную связь между атомами. Она характеризуется направленностью электронной области и возможностью вращения вокруг своей оси.
Переходим к пи связи. Она представляет собой более слабую связь, которая возникает между п парой электронов, находящихся в п орбитале атомов. Пи связь не является направленной, поэтому она представляет собой меньшую степень связывания атомов, в сравнении со сигма связью. Кроме того, она ограничена возможностью вращения вокруг своей оси.
Таким образом, ключевые особенности структур сигма и пи связей заключаются в направленности электронной области и уровне связывания атомов. Сигма связь обеспечивает прочность и стабильность, в то время как пи связь создает дополнительные возможности для взаимодействия электронных облаков разных атомов. Понимание этих особенностей является ключом к пониманию химических свойств соединений и молекулы в целом.
Влияние сигма и пи связей на химические свойства веществ

Сигма и пи связи – это два основных типа химических связей между атомами в молекуле. Сигма связи образуются при перекрытии двух орбиталей, прямо соединяющих атомы молекулы. Они характеризуются высокой степенью направленности и обеспечивают прочность и устойчивость молекулы. Пи связи образуются при перекрытии параллельных орбиталей, в основном p-орбиталей, находящихся над и под плоскостью сигма связи. Они обладают слабой направленностью и могут быть легко сформированы и разрушены.
На формирование сигма и пи связей влияют различные факторы, такие как электронная структура атомов и предшествующие химические реакции. Сигма связи обычно образуются между атомами с низким различием электроотрицательности и сильным наложением орбиталей. Их образование способствует укреплению молекулярной структуры и повышению плотности электронов в межатомном пространстве.
Пи связи образуются при перекрытии побочных орбиталей, которые находятся выше и ниже плоскости сигма связи. Они обеспечивают возможность деликатных колебаний и вращений молекулы, что может сказываться на её свойствах. Пи связи могут быть слабыми и легко разрываться при воздействии внешних факторов. Также они могут участвовать в образовании мезомерии и влиять на расположение и реакционную способность функциональных групп.
Влияние сигма и пи связей на химические свойства веществ имеет большое значение при изучении реакций и прогнозировании их ходов. Понимание роли и взаимодействия этих связей позволяет уточнить механизмы химических реакций и объяснить различные физико-химические явления. Это дает возможность разрабатывать новые вещества с определенными свойствами и использовать их в различных областях науки и промышленности.
Энергетическая стабильность сигма и пи связей: сравнение и различия
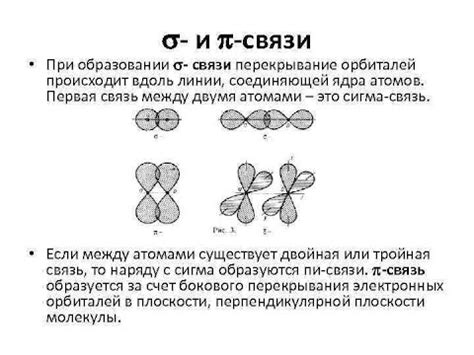
Одной из основных различий между сигма и пи связями является их пространственное расположение. Сигма-связь формируется напрямую между двумя атомами, образуя прямую ось связи, в то время как пи-связь образуется параллельно оси связи, создавая боковую симметрию. Это различие в геометрии сигма и пи связей влияет на их энергетическую стабильность.
Сигма-связь, благодаря своей прямой оси и наилучшему перекрытию орбиталей атомов, обладает большей энергетической стабильностью по сравнению с пи-связью. Это обусловлено более эффективным перекрытием электронных облаков и большей симметрией осей связи. В результате сигма-связи обычно сильнее пи-связей и более устойчивы к разрушению.
Однако, пи-связь также играет важную роль в молекулярном строении и химических реакциях. Пи-связи обеспечивают ароматическую стабильность, специфическую реакционную активность и конформационные свойства молекул. Несмотря на относительную слабость пи-связей, они имеют важное значение для формирования молекулярной структуры веществ и определения их свойств.
Факторы, влияющие на энергетическую стабильность сигма и пи связей
1. Геометрия молекул: Форма молекулы может оказывать значительное влияние на стабильность сигма и пи связей. Например, линейная молекула сигма-связанных атомов может быть более стабильной, чем молекула сигма-связанных атомов, которая имеет изогнутую форму. Это связано с тем, что при линейной конфигурации энергия связи распределяется равномерно между атомами, в то время как при изогнутой форме энергия связи распределена неравномерно.
2. Вид связующего атома: Тип атома, который участвует в формировании связи, также может оказать влияние на стабильность сигма и пи связей. Например, углеродные атомы в органических соединениях могут образовывать более стабильные пи связи, чем атомы других элементов. Это связано с наличием плоской электронной структуры углерода, которая обеспечивает более эффективное перекрывание орбиталей и образование пи связей с меньшей энергией.
3. Электронная плотность: Количество электронов и их распределение в молекуле также важны для энергетической стабильности сигма и пи связей. Большая электронная плотность в молекуле может привести к образованию более сильных связей. Например, наличие дополнительных электронных групп, таких как электроотрицательные атомы или альтернативные пи-электронные системы, может усилить силу пи связей.
Почему сигма связи обладают большей стабильностью, чем пи связи?

Сигма связи образуются, когда два атома перекрываются непосредственно по своим орбиталям. Такое расположение электронов создает симметричную и приплюсовую область электронной плотности между атомами, что позволяет им удерживаться вместе. Это связь более прочная, так как электронная плотность распределена равномерно по всей связи, что обеспечивает сильную силу связи.
Пи связи, с другой стороны, образуются, когда орбитали атомов перекрываются боковыми поверхностями. В этом случае электронная плотность концентрируется вдоль области перекрытия, а не равномерно распределена по всей связи. Такое неравномерное распределение электронов делает пи связи менее стабильными, потому что электронная плотность сконцентрирована в узкой области и более подвержена внешним воздействиям.
Роль сигма и пи связей в реакциях химических превращений

Сигма связи можно назвать по своей природе самыми простыми и прямолинейными, они образуются при перекрытии s- и p-орбиталей двух атомов. Эти связи представляют собой прочные и стабильные взаимодействия и являются основой для построения многих органических и неорганических молекул. Они отвечают за удержание атомов в молекуле и детерминируют ее структуру и свойства.
Пи связи, в свою очередь, являются более сложными структурами, которые образуются при перекрытии p-орбиталей двух атомов. Они отвечают за конъюгацию электронных областей в молекуле, что может приводить к увеличению ее стабильности и электронной проводимости. Пи связи встречаются в ароматических соединениях, двойных и тройных связях, а также в мезомерии и других эффектах, которые могут значительно влиять на реакционные способности молекулы.
Изучение и понимание роли сигма и пи связей в реакциях химических превращений играет важную роль в практической химии. Это позволяет предсказывать и объяснять результаты реакций, а также разрабатывать новые методы синтеза и модификации веществ. Более глубокое понимание этих типов связей позволяет нам лучше управлять химическими реакциями и создавать новые материалы с определенными свойствами и функциональностью.
Реакции химических превращений, в которых участвуют сигма связи

Сигма связи обладают высокой степенью симметрии и сильной асимметрией зарядов, что позволяет им участвовать в различных реакциях. Они могут быть подвергнуты атакам и превращениям, что способствует образованию новых химических соединений.
- 1. Реакции аддиции: Сигма связи могут служить платформой для присоединения других атомов или групп атомов к молекуле. Например, при аддиции атома водорода к двойной связи в алкене образуется новая сигма-связь между атомом водорода и алкеном.
- 2. Реакции замещения: В реакциях замещения, одни атомы или группы атомов замещают другие атомы или группы атомов в молекуле соединения. Сигма связи могут быть вовлечены в образование новых связей или разрыв существующих связей.
- 3. Реакции разрыва связи: Сигма связи могут подвергаться разрыву при проведении химических реакций. Это может привести к образованию новых продуктов, содержащих свободные радикальные или ионные частицы.
- 4. Реакции циклизации: В химических реакциях сигма связи могут участвовать в процессе циклизации, что позволяет образовывать кольца или циклические соединения.
Таким образом, сигма связи играют важную роль в химических превращениях, создавая возможности для образования новых соединений и структур. Знание о реакциях, которые могут происходить с участием сигма связей, позволяет углубить наше понимание основ химии и применить его в различных областях, от синтеза новых лекарств до процессов внутри нашего организма.
Влияние пи связей на реакционную активность молекул
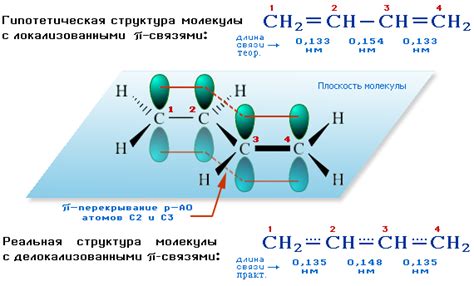
В отличие от сигма связей, которые формируются из-за перекрытия орбиталей s и p, пи связи возникают благодаря перекрытию площади орбиталей p, и это делает их особенно интересными. Пи связи обладают некоторыми уникальными свойствами, которые оказывают влияние на структуру и свойства молекул.
- Влияние пи связей на реакционную активность
Первым важным аспектом является то, что пи связи способны образовывать сопряженные системы, что приводит к стабилизации электронного состояния молекулы. Это в свою очередь может значительно повлиять на химическую реакционную активность.
Участие пи связей в реакциях может изменять энергетический барьер для образования или разрыва химических связей. При наличии сопряженных систем энергия активации реакций может быть ниже, что делает молекулы более реакционноспособными.
Кроме того, пи связи могут формировать конъюгированные системы пи-электронной области, что приводит к возникновению новых электронных состояний. Это, в свою очередь, может создавать дополнительные возможности для реакций и изменять их продукты.
Таким образом, изучение влияния пи связей на реакционную активность молекул играет важную роль в развитии органической химии и позволяет более глубоко понять и контролировать химические реакции.
Вопрос-ответ

Какова разница между сигма и пи связями в химии?
Сигма-связь (σ-связь) - это тип химической связи, характеризующийся перекрытием атомных орбиталей, проходящим между ядрами атомов, объединяемых данной связью. Она является самой простой и наиболее распространенной формой связи. Пи-связь (π-связь) - это тип химической связи, который образуется в результате перекрытия параллельных пи-орбиталей атомов. Она является более сложной и более слабой по сравнению с сигма-связью.
Чем отличается энергия сигма и пи связей?
Сигма-связь имеет более низкую энергию, чем пи-связь. Это связано с тем, что перекрытие атомных орбиталей при формировании сигма-связи происходит по всей их длине, что обеспечивает более сильную связь. В то время как пи-связь образуется только в определенных областях параллельных пи-орбиталей, что делает ее более слабой по сравнению с сигма-связью.
Какие атомы могут образовывать сигма и пи связи?
Сигма-связь может образовываться между любыми атомами, включая углерод, кислород, азот, водород и т.д. Она является наиболее распространенным типом связи в органической и неорганической химии. Пи-связь, с другой стороны, образуется только между атомами, имеющими параллельные пи-орбитали, такими как атомы углерода в двойных и тройных связях.



