Изучение химических элементов и их свойств было одной из важнейших задач науки в XIX веке. В 1869 году русский химик Дмитрий Иванович Менделеев предложил первую версию периодической системы химических элементов, которую называют таблицей Менделеева. Это стало огромным прорывом, который изменил науку и открыл новые горизонты для исследований.
Однако создание периодической таблицы было результатом долгих и сложных экспериментов и наблюдений. За несколько десятилетий до Менделеева французский химик Антуан Лавуазье разработал понятие химического элемента и его состава. Это привело к началу систематического изучения различных элементов, исследованию их свойств и составления первых списков элементов.
Однако долгое время ученые сталкивались с проблемой классификации элементов и не могли найти правильную структуру таблицы элементов. Они знали лишь общие закономерности, но не могли объяснить, почему элементы расположены именно таким образом. Это привело к созданию различных версий классификации элементов, но ни одна из них не была идеальной.
Открытие нового химического элемента

Первый шаг в открытии нового химического элемента начинается с наблюдения и выявления новых свойств вещества. Ученые проводят эксперименты, в результате которых возникает предположение о существовании нового элемента. Это может происходить на основе анализа химических соединений или наблюдения за физическими свойствами вещества.
Дальнейший этап включает изоляцию и получение нового элемента в чистом виде. Это достигается через различные методы, такие как химическая синтез, расщепление соединений или использование ускорителей частиц.
После изоляции элемента проводится подтверждающий анализ, который включает определение его электронной структуры, массы, температуры плавления и других характеристик. Ученые также проводят эксперименты для проверки химической активности нового элемента и его взаимодействия с другими веществами.
После успешного прохождения всех этапов открытия нового химического элемента, его результаты публикуются в научных журналах и представляются на специализированных конференциях и симпозиумах. Это позволяет другим ученым изучить и подтвердить результаты исследования, а также принять новый элемент в состав периодической таблицы Менделеева.
| Шаги открытия нового химического элемента: |
|---|
| 1. Наблюдение и выявление новых свойств вещества. |
| 2. Изоляция и получение нового элемента в чистом виде. |
| 3. Подтверждающий анализ характеристик нового элемента. |
| 4. Публикация результатов исследования и включение нового элемента в периодическую таблицу Менделеева. |
Открытие новых химических элементов является важным достижением в научных исследованиях и способствует расширению наших знаний и понимания о мире вещества.
Изучение свойств открытых элементов

Разработка периодической таблицы Менделеева была огромным прорывом в области химии и открытии новых элементов. Однако, открытие элементов само по себе было только первым шагом в их изучении и понимании свойств.
Ученые провели множество экспериментов и исследований для определения физических и химических свойств открытых элементов. Они исследовали их электронную структуру, валентность, массу, плотность, точку плавления и кипения, а также множество других характеристик.
Важной особенностью периодической таблицы Менделеева является ее способность предсказывать свойства еще не открытых элементов. Благодаря систематическому расположению элементов по группам и периодам, ученые смогли установить общие закономерности и тренды, которые помогли в дальнейшем открыть и изучить новые элементы.
Одним из ключевых событий в истории изучения свойств открытых элементов было открытие радиоактивных элементов Марией и Пьером Кюри. Их открытие и исследование привело к новым открытиям в области радиоактивности и сильно повлияло на развитие ядерной физики и химии.
Сегодня ученые продолжают исследовать свойства новых и уже известных элементов. Современные методы и технологии позволяют проводить более точные и подробные исследования, что расширяет наше понимание химических свойств элементов и их применение в различных областях науки и техники.
Изучение свойств открытых элементов является важным этапом в истории развития периодической таблицы Менделеева и способствует постоянному расширению наших знаний о химии и природе веществ.
Определение атомных масс элементов

Определение атомных масс элементов было одним из важных этапов в развитии периодической таблицы Менделеева. В начале XIX века французский химик Жозеф Луи Гей-Люссак и итальянский химик Амадео Авогадро разработали гипотезу о равенстве объемов газов при одинаковых условиях температуры и давления, которая затем была названа гипотезой Авогадро.
В 1860-х годах российский химик Дмитрий Иванович Менделеев провел исследования и разработал концепцию периодического закона, согласно которому свойства элементов повторяются периодически с изменением атомных масс. Однако для полноценного составления периодической системы Менделееву требовались точные значения атомных масс.
Важной ролью в определении атомных масс элементов сыграли работы немецких химиков Юстуса фон Либиха и Вильгельма Оствальда. Либих разработал методику определения атомных масс на основе нескольких свойств элементов, включая их отношение к водороду. Оствальд в свою очередь предложил использовать результаты электростатических измерений для получения более точных данных о атомных массах.
Современные методы определения атомных масс включают использование масс-спектрометрии, гравиметрии и физических методов. Определение точных атомных масс является важным для правильного расположения элементов в периодической таблице и понимания их свойств и взаимодействий.
Формулировка закономерностей в периодическом законе

Основная формулировка периодического закона состоит в следующем: "Свойства химических элементов периодически изменяются по мере изменения их атомного номера". То есть, с ростом атомного номера, свойства элементов проявляют тенденцию к повторению, образуя периоды и группы в периодической таблице Менделеева.
Основные закономерности, сформулированные в периодическом законе, включают следующие:
| Закономерность | Описание |
|---|---|
| Периодичность радиусов атомов | С ростом атомного номера, радиусы атомов увеличиваются внутри каждого периода и уменьшаются при переходе на следующий период. |
| Периодичность ионизационной энергии | С ростом атомного номера, ионизационная энергия элементов обычно увеличивается, то есть, энергия, необходимая для отрыва электрона от атома, возрастает. |
| Периодичность электроотрицательности | С ростом атомного номера, электроотрицательность элементов, как правило, увеличивается. |
| Периодичность химических свойств | По мере изменения атомного номера, химические свойства элементов периодически повторяются, что обусловлено изменением строения электронных оболочек. |
Эти закономерности позволяют предсказывать и объяснять свойства элементов на основе их положения в периодической таблице. Они играют важную роль в изучении и применении химических элементов, а также в разработке различных химических процессов и материалов.
Создание предварительных версий таблицы Менделеева

1. Прототипы таблицы Менделеева
Создание и развитие понятия о химических элементах и их свойствах происходило на протяжении долгого времени. Еще в IV веке до н.э. греческий философ Демокрит предложил идею о наличии определенных "неделимых" частиц, которые впоследствии получили название атомов. Однако, систематизация этих частиц и их свойств была значительно сложнее.
В 1789 году французский химик Антуан Лавуазье предложил первую классификацию элементов, разделив их на металлы и неметаллы. Это стало первым шагом в создании таблицы элементов.
2. Разработка прототипа Дениса Ювона
В 1817 году шведский химик Йохан Афгансениус создал первый прототип таблицы, в котором элементы были расположены по возрастанию атомной массы. Однако, его работа не получила широкого признания и влияния.
3. Открытие циклической природы элементов
В середине XIX века немецкий физик Йоганн Доберейнер обнаружил, что некоторые группы элементов обладают схожими химическими свойствами и образуют так называемые триады - группы из трех элементов, в которых средний элемент обладает средними свойствами сторонних элементов. Однако, систематической закономерности в расположении элементов это не обеспечило.
В 1863 году выдающийся русский химик Дмитрий Иванович Менделеев заметил, что свойства элементов могут быть связаны с их атомными массами. Он создал таблицу, в которой элементы располагались по возрастанию массы, а также сгруппированы по похожим свойствам. Этот прототип таблицы Менделеева позволил ему предсказать существование некоторых элементов, которые еще не были открыты на тот момент.
4. Периодическая система Менделеева
В 1869 году Менделеев объявил о создании периодической таблицы элементов, в которой элементы расположены в порядке возрастания атомной массы и сгруппированы по похожим свойствам. Благодаря этой таблице химики смогли систематизировать знания о химических элементах и использовать их для открытия новых веществ и развития науки в целом.
Публикация первой версии периодической таблицы Менделеева

В 1869 году русский химик Дмитрий Иванович Менделеев опубликовал свою первую версию периодической таблицы химических элементов. Это стало громадным прорывом в области химии и стало отправной точкой для дальнейших исследований и открытий в области химических элементов.
До этого момента, существовали различные попытки систематизировать химические элементы, но ни одна из них не была настолько полной и компактной, как периодическая таблица Менделеева. Он организовал элементы в виде таблицы, где они были упорядочены по возрастанию атомного номера, группировались по химическим свойствам и располагались в порядке возрастающей относительной атомной массы.
Менделеев оставил несколько пустых мест в таблице, предполагая, что в будущем будут открыты новые элементы, которые будут соответствовать этим местам. Это предсказание было удивительно точным, поскольку впоследствии были открыты именно те элементы, которые соответствовали пустым местам.
Разработка Менделеевой периодической системы стала важным инструментом для организации знаний о химических элементах и их свойствах, а также для предсказания и дальнейшего открытия новых элементов. Это стало значительным вкладом в историю химии и оказало влияние на множество последующих открытий и исследований.
Постепенное дополнение и уточнение таблицы Менделеева
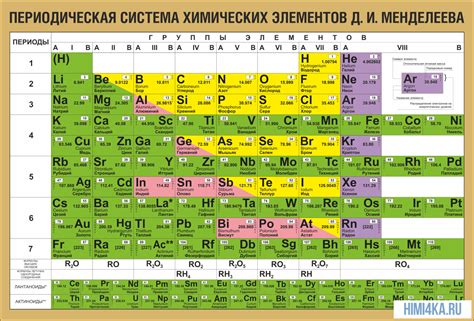
Таблица Менделеева была создана Дмитрием Ивановичем Менделеевым в 1869 году. В своей исходной форме она содержала только 63 элемента и была упорядочена по возрастанию атомной массы. Однако с течением времени таблица Менделеева подверглась постепенному дополнению и уточнению.
Первое значительное обновление таблицы произошло в 1871 году, когда были добавлены элементы основных подгрупп. В 1875 году Менделеевым были предсказаны и описаны свойства трех новых элементов: германия, галлия и скандия. Эти элементы были открыты несколькими учеными в течение следующих лет и включены в таблицу.
В ходе дальнейших исследований, проводимых различными учеными, было открыто все больше новых элементов и уточнено их расположение в таблице. Это позволило включить в таблицу такие элементы, как серебро, алюминий, кадмий и другие.
Главным этапом развития таблицы Менделеева стало открытие радиоактивности и открытие новых радиоактивных элементов. Это привело к созданию расширенной таблицы Менделеева, которая содержала не только простые элементы, но и элементы-изотопы с различным числом нейтронов в ядре.
Сегодня таблица Менделеева состоит из 118 элементов, упорядоченных по возрастанию атомного номера. Она является основным инструментом в химии и позволяет ученым классифицировать, анализировать и предсказывать свойства элементов.
| Периоды | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
|---|---|---|---|---|---|---|---|
| Группы | 1 IA (самые активные металлы) | 2 IIB (Нет только металлов) | 3 IIIA | 4 IVA | 5 VA | 6 VIA | 7 VIIA (самые активны неметаллы) |



