Железо является одним из самых распространенных элементов в природе и играет важную роль в различных химических процессах. Однако, у железа существует две основные валентности - 2 и 3. Определить, в какой валентности находится железо в конкретном соединении, может оказаться непросто. Знание валентности железа является ключевым для понимания его химической активности и использования в различных процессах.
Один из самых распространенных способов определения валентности железа - анализ его окислительного состояния. Железо восстанавливается до двухвалентного (Fe2+) или трехвалентного (Fe3+) состояния путем добавления соответствующих окислителей. Принципиальное различие между двухвалентным и трехвалентным железом состоит в количестве переданных электронов при окислении. Таким образом, анализ окислительного состояния предоставляет нам понимание о валентности железа.
Второй способ определения валентности железа - анализ его химических свойств. Некоторые соединения железа, содержащие двухвалентное железо, обладают характерными свойствами, отличными от трехвалентного железа. Например, двухвалентное железо обычно образует растворимые соединения с синей окраской, в то время как трехвалентное железо образует не растворимые соединения с красновато-коричневой окраской. Другие химические свойства, такие как реакция с кислородом или солями, также могут иметь важное значение при определении валентности железа.
Методы определения валентности железа 2 или 3

Валентность железа может быть определена несколькими методами, которые позволяют установить, в какой степени железо находится в окружении с другими химическими элементами.
Один из основных и наиболее распространенных методов - спектроскопический анализ. Используя спектроскопические приборы, можно исследовать спектральные характеристики железа и определить его валентность. Анализируя энергию и интенсивность поглощенного, испущенного или отраженного излучения, можно получить информацию о конкретной валентности железа.
Также применяются методы химического анализа, например, окислительно-восстановительные реакции. Железо в разных валентностях проявляет разную активность в реакциях с окислителями и восстановителями. Путем измерения скорости реакций можно определить валентность железа.
Еще один распространенный метод - магнитометрическое исследование. Железо может образовывать соединения с разной магнитной активностью в зависимости от своей валентности. Измерение магнитных свойств материала позволяет определить, в какой степени вещество содержит железо в одной или другой валентности.
Наконец, электрохимические методы также широко применяются для определения валентности железа. Измерение потенциала или тока в электрохимических реакциях, в которых принимает участие железо, позволяет определить его валентность.
В зависимости от доступных инструментов и оборудования, а также от конкретных условий и требований исследования, выбирается подходящий метод определения валентности железа 2 или 3.
Анализ свойств соединения
Определение валентности железа в данном соединении осуществляется путем анализа его химических и физических свойств.
Комбинирование этих методов анализа позволяет более точно определить валентность железа в данном соединении и лучше понять его химическую природу и свойства.
Магнитные свойства вещества
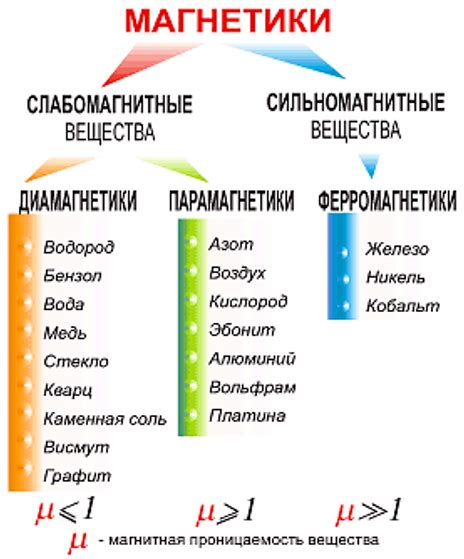
Магнитные свойства вещества зависят от валентности атома железа. Валентность определяет количество электронов во внешней электронной оболочке атома и его способность образовывать связи с другими атомами. Кристаллические соединения железа с валентностью 2 и 3 обладают различными магнитными свойствами.
Железо со валентностью 2 (Fe2+) обладает парамагнитными свойствами. В таких веществах атомы железа имеют некомпенсированные спины электронов, что делает их подверженными внешнему магнитному полю. Под действием магнитного поля электроны начинают выстраиваться вдоль направления поля, создавая слабый магнитный момент. Но парамагнитные вещества обладают слабой силой взаимодействия с магнитным полем и не проявляют перманентный магнетизм в отсутствие внешнего поля.
Валентность железа 3 (Fe3+) приводит к появлению ферромагнитных свойств. В ферромагнитных веществах атомы железа имеют сильно компенсированные спины, что приводит к появлению спонтанного магнетизма. Под действием внешнего магнитного поля они ориентируются вдоль его линий силы и образуют упорядоченные магнитные домены, в результате чего вещество становится намагниченным. Ферромагнитные вещества сохраняют свой магнетизм и в отсутствии внешнего поля.
Реакции с окислителями

Железо может проявлять свою валентность 2 или 3, что влияет на его способность окисляться или восстанавливаться. Рассмотрим некоторые реакции железа с окислителями.
| Валентность железа | Реакция с окислителем |
|---|---|
| 2 | Железо(II) окисляется до железа(III), например: |
| FeSO4 + H2O2 –> Fe(SO4)3 + H2O | |
| Железо(II) окисляется до железа(III) в присутствии кислорода: | |
| 4FeSO4 + O2 + 2H2O –> 2Fe2(SO4)3 + 2H2SO4 | |
| 3 | Железо(III) восстанавливается до железа(II), например: |
| 2FeCl3 + SnCl2 –> 2FeCl2 + SnCl4 | |
| Железо(III) восстанавливается до железа(II) в присутствии меди: | |
| 2FeCl3 + 3Cu –> 2FeCl2 + 3CuCl |
Это лишь некоторые примеры реакций, которые демонстрируют различную валентность железа и его взаимодействие с окислителями.
Реакция с пероксидом водорода
Для определения валентности железа, часто используется реакция с пероксидом водорода. Эта реакция позволяет определить, в какой степени железо окислено, и, следовательно, валентность этого элемента.
Реакция происходит следующим образом:
Fe + H2O2 → Fe3+ + OH- + H2O
В этой реакции железо вступает в реакцию с пероксидом водорода и окисляется до иона железа(III), образуя гидроксидное ионы и воду.
Если в результате реакции железо окисляется до иона железа(III), то валентность железа равна 3. Если же железо окисляется только до иона железа(II), то его валентность равна 2.
Таким образом, реакция с пероксидом водорода является одним из методов определения валентности железа.
Реакция с хлором
Хлор (Cl2) реагирует с железом и может помочь определить его валентность.
Если добавить железо (Fe) в раствор хлора, то произойдет реакция:
2Fe + 3Cl2 → 2FeCl3
Эта реакция указывает на валентность железа равную 3.
Если добавить хлорид железа (III) (FeCl3) к воде, образуется кислый раствор:
FeCl3 + 3H2O → Fe(OH)3 + 3HCl
Таким образом, реакция с хлором позволяет определить валентность железа и установить его состояние окисления.
Реакция с серной кислотой
Если железо вступает в реакцию валентности 2, то образуется сернокислое железо(II) - FeSO4. Реакция протекает следующим образом:
- Fe + H2SO4 → FeSO4 + H2
В полученном соединении железо находится в состоянии валентности +2.
Если железо вступает в реакцию валентности 3, то образуется сульфат железа(III) - Fe2(SO4)3. Реакция протекает следующим образом:
- 2Fe + 3H2SO4 → Fe2(SO4)3 + 3H2
В полученном соединении железо находится в состоянии валентности +3.
Таким образом, реакция железа с серной кислотой позволяет определить его валентность по типу образующегося соединения. Это важное сведение для дальнейшего изучения свойств и реакций железа.



