Ионная связь и ковалентная полярная являются двумя основными типами химических связей, которые возникают между атомами и молекулами. Понимание различий между этими двумя типами связей важно для понимания молекулярной структуры веществ и их свойств.
Ионная связь образуется, когда атомы сильно различаются в их электроотрицательности. Электроотрицательность - это способность атома притягивать электроны в связи. В ионной связи один атом становится положительно заряженным (ионом катионом), а другой атом становится отрицательно заряженным (ионом анионом), поскольку один атом принимает электроны, а другой отдает их. Это создает силу притяжения между ионами, что держит их вместе в кристаллической решетке или структуре.
С другой стороны, ковалентная полярная связь образуется, когда атомы имеют различие в их электроотрицательности, но не настолько сильное, чтобы создать ион. Вместо этого электроны, участвующие в связи, перетягиваются ближе к атому с более высокой электроотрицательностью, создавая положительный и отрицательный конец молекулы. Это создает полярность в молекуле, где одна сторона немного более положительна, а другая немного более отрицательна.
Когда и как образуется ионная связь

Ионная связь обычно возникает между металлами и неметаллами, когда различные силы притяжения между заряженными частицами обеспечивают стабильность соединения. Металлы обычно отдают электроны и образуют положительные ионы, а неметаллы принимают электроны и образуют отрицательные ионы.
В результате образования ионной связи образуются кристаллические структуры, в которых положительно и отрицательно заряженные ионы образуют регулярную 3D-решетку. Такие вещества обладают характеристиками, такими как высокая температура плавления и кипения, хорошая электропроводность в расплавленном или растворенном состоянии, и хрупкость в твердом состоянии.
Примерами веществ, образующих ионные связи, являются соли, кислоты, щелочи и многие другие неорганические соединения. Эти соединения обычно образуются при реакциях между металлами и неметаллами, таких как натрий и хлор, которые образуют соль натрия и хлорида.
| Примеры веществ с ионной связью | Формула | Наименование |
|---|---|---|
| Соль натрия | NaCl | Хлорид натрия |
| Соль калия | KCl | Хлорид калия |
| Кальций хлорид | CaCl2 | Хлорид кальция |
Механизм образования ионной связи

Ионная связь образуется между атомами, которые имеют разное количество электронов во внешней оболочке. В основе этого механизма лежит перенос электронов от одного атома к другому.
Когда один атом обладает низкой электроотрицательностью и имеет одно или несколько электронов в валентной оболочке, а другой атом обладает высокой электроотрицательностью и имеет недостаток электронов, происходит образование ионной связи. Атом с низкой электроотрицательностью, отдавая свои электроны, превращается в положительно заряженный ион – катион, а атом с высокой электроотрицательностью, получая электроны, превращается в отрицательно заряженный ион – анион.
Катионы и анионы притягиваются друг к другу электростатической силой, что создает ионную связь. Данный тип связи является довольно крепким, так как электрические силы взаимодействия между зарядами ионов велики. Также ионная связь характеризуется тем, что она является неполярной и дает образование кристаллических структур, таких как соль или минералы.
Примеры веществ, образующих ионную связь

1. Хлорид натрия (NaCl)
Хлорид натрия является классическим примером вещества, образующего ионную связь. В данном случае, натрий (Na) отдаёт один электрон, становясь положительно заряженным ионом Na+, а хлор (Cl) принимает этот электрон, становясь отрицательно заряженным ионом Cl-. Таким образом, осуществляется электростатическое взаимодействие между атомами натрия и хлора.
2. Гидроксид натрия (NaOH)
Гидроксид натрия также является примером вещества с ионной связью. Здесь натрий отдаёт один электрон, образуя положительно заряженный ион Na+, а гидроксильная группа (OH) принимает этот электрон, образуя отрицательно заряженный ион OH-. Это приводит к образованию соединения NaOH, в котором натрий и гидроксильная группа притягиваются друг к другу через ионную связь.
3. Бромид калия (KBr)
Бромид калия также является примером вещества с ионной связью. В данном случае, калий отдаёт один электрон, образуя положительно заряженный ион K+, а бром принимает этот электрон, образуя отрицательно заряженный ион Br-. Это приводит к образованию соединения KBr, в котором калий и бром притягиваются друг к другу через ионную связь.
4. Оксид магния (MgO)
Оксид магния также является примером вещества с ионной связью. Здесь магний отдаёт два электрона, образуя два положительно заряженных иона Mg2+, а кислород принимает эти электроны, образуя два отрицательно заряженных иона O2-. Это приводит к образованию соединения MgO, в котором магний и кислород притягиваются друг к другу через ионную связь.
Это лишь некоторые примеры веществ, образующих ионную связь. В реальности множество химических соединений основаны на ионной связи и имеют различные комбинации ионов.
Когда и как образуется ковалентная полярная связь
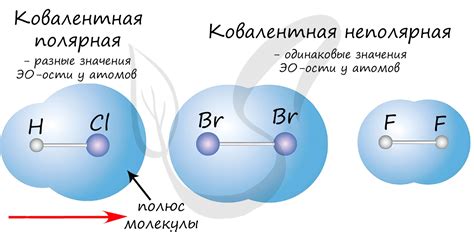
Ковалентная связь характеризуется общим использованием пар электронов атомами для образования связи. Однако, в случае полярной связи, электроны проводимы ближе к атому с более высокой электроотрицательностью.
Образование полярной связи может приводить к формированию полярных молекул, в которых есть положительный и отрицательный конец.
Формирование ковалентной полярной связи важно в ряде химических реакций, включая образование молекул органических соединений, растворение веществ в поларных растворителях и образование водородных связей.



