Химические реакции являются основным объектом изучения в химии. Однако, не все реакции между веществами происходят в направлении образования новых веществ. В зависимости от условий проведения реакции и агентов, участвующих в реакции, может быть как обратимая, так и необратимая реакция.
Обратимая реакция – это такая химическая реакция, которая может протекать как в прямом, так и в обратном направлении. Это значит, что продукты реакции могут стать реакционными веществами и наоборот. В обратимых реакциях обычно имеются составные части, которые могут образовывать равновесие. Восстановление равновесия может происходить в результате изменения концентрации или температуры системы. Примером обратимой реакции является реакция образования воды из водорода и кислорода.
В отличие от обратимой реакции, необратимая реакция протекает только в одном направлении и не возвращается к исходным веществам. Это связано с невозможностью восстановления исходного состояния системы. Примером необратимой реакции является горение, при котором происходит окисление веществ и образование продуктов с более высокой энергией. Необратимые реакции обычно протекают с выделением значительного количества энергии.
Когда реакции идут назад

Реакции химических процессов могут протекать вперед или назад в зависимости от условий, в которых они происходят. В некоторых случаях реакции могут идти назад, то есть обратимы.
Одним из ключевых факторов, влияющих на обратимость реакции, является равновесие. Если система находится в равновесии, то скорости прямой и обратной реакций становятся равными, и происходит динамическое равновесие.
Обратимые реакции часто характеризуются специфическим обозначением, используемым в химическом уравнении - двусекционной стрелкой. Примером обратимой реакции является реакция обратного превращения воды в воду и кислород.
| Прямая реакция | Обратная реакция |
|---|---|
| H2O -> H2 + 0.5O2 | H2 + 0.5O2 -> H2O |
При определенных условиях обратимая реакция может стать необратимой. Это может произойти, например, когда одно из реагентов полностью исчерпывается или когда достигается термодинамическое равновесие
Знание условий, при которых реакции могут идти назад, является важным для понимания и управления химическими процессами.
При катализе

Катализ может быть обратимым или необратимым, в зависимости от конкретной реакции и условий. Если катализатор полностью востанавливается после реакции, то он является обратимым катализатором. Обратимый катализатор может использоваться повторно для проведения множества циклов реакции.
В случае необратимого катализа, катализатор накапливается в виде продукта реакции и не может быть восстановлен до исходного состояния. Необратимый катализ позволяет провести реакцию, которая иначе могла бы быть затруднительной или невозможной без наличия катализатора.
Обратимый катализ позволяет управлять скоростью реакции, изменять условия и контролировать образование продуктов. Необратимый катализ может быть использован для повышения загрузки катализатора и экономии ресурсов.
При наличии равновесия
Реакция считается обратимой, если система достигает равновесия и может вернуться к исходным веществам при изменении условий реакции. При наличии равновесия реакции продолжают протекать в обе стороны в равных количествах, сохраняя константу равновесия.
Причинами, приводящими к обратимости реакции, могут быть:
- Низкая энергия активации.
- Правильная концентрация реагентов.
- Наличие катализаторов или ферментов.
Обратимые реакции часто встречаются в естественных процессах, таких как дыхание, ферментативные реакции в организмах, а также в промышленных процессах, например, в производстве аммиака.
Однако не все реакции обратимы. Реакция считается необратимой, если система не может вернуться к исходным веществам при изменении условий, например, при удалении продуктов реакции или при высоких концентрациях.
Необратимые реакции часто происходят взрывоопасных и пиротехнических смесях, а также в реакциях с высокими температурами и давлениями, когда обратное протекание реакции становится энергетически невыгодным.
Когда реакции не могут обратиться

Некоторые химические реакции не могут обратиться в исходные реагенты. Это может происходить по разным причинам:
1. Односторонние реакции: Есть ряд химических реакций, которые происходят только в одном направлении. Например, реакция горения, в которой вещество полностью окисляется, и невозможно восстановить исходные реагенты из продуктов реакции.
2. Реакции с высокой энергией активации: Некоторые химические реакции происходят со значительным поглощением энергии. Восстановление исходных реагентов в таких реакциях требует очень больших энергетических затрат, поэтому эти реакции практически не обратимы.
3. Реакции с образованием продуктов, которые быстро реагируют: В некоторых случаях продукты реакции могут сразу же реагировать с другими реагентами, не давая возможности реакции обратиться. Это может быть связано с особыми условиями, такими как высокая температура или наличие катализаторов.
Механизмы и условия реакции играют важную роль в определении обратимости процесса. Понимание того, когда реакции могут и не могут обратиться, важно для практического применения химических процессов в различных областях, включая промышленность и научные исследования.
При исчезновении реагентов
В реакциях, которые подразумевают полное исчезновение реагентов, можно говорить о необратимой реакции. В таких случаях реагенты полностью переходят в реакционные продукты и не могут быть восстановлены в исходное состояние.
Необратимые реакции обычно происходят с образованием новых веществ или с изменением свойств исходных реагентов. Это может быть, например, образование нерастворимого осадка или газа, изменение цвета раствора или образование новых химических связей.
Обратимые реакции, напротив, могут протекать в обоих направлениях. Это означает, что реагенты могут быть восстановлены из реакционных продуктов, если условия реакции изменятся или если добавить дополнительные реагенты.
Реакциями, которые можно считать обратимыми, являются, например, равновесные реакции, в которых протекает обратимый процесс установления равновесия между реагентами и продуктами. Такие реакции могут продолжаться в течение длительного времени, пока условия реакции не изменятся.
Важно понимать, что обратимость реакции зависит от условий проведения реакции. Изменение температуры, давления, концентрации реагентов или добавление катализатора может влиять на обратимость реакции, делая ее обратимой или необратимой.
При отсутствии переходного состояния
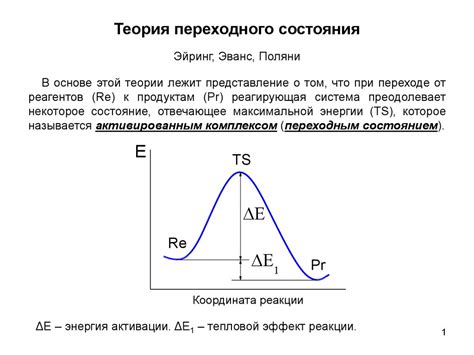
В некоторых реакциях химических веществ переходят из исходного состояния в конечное без образования промежуточного переходного состояния. Такие реакции называются прямыми реакциями. В прямых реакциях все входные вещества превращаются в выходные без образования промежуточных продуктов. Прямые реакции часто происходят без вмешательства внешних факторов и происходят естественным путем.
Примером такой реакции является горение бумаги, при котором кислород из воздуха взаимодействует с углеродом в бумаге, образуя углекислый газ и воду:
кислород + углерод (в бумаге) → углекислый газ + вода
В прямых реакциях изменение состояния химических веществ происходит без обратимости. То есть, исходные вещества полностью превращаются в конечные продукты и не могут восстановиться в исходное состояние.
Это отличает прямые реакции от обратимых реакций, при которых происходит образование промежуточного переходного состояния и вещества могут возвращаться в исходное состояние при изменении условий реакции.
Влияние условий на обратимость реакций

Обратимыми реакциями называют такие химические процессы, которые могут протекать в обе стороны в зависимости от условий. То есть, если начальные реагенты переходят в продукты, то в обратимой реакции продукты могут также обратно превратиться в реагенты.
Одним из факторов, влияющих на обратимость реакций, является концентрация реагентов. Если концентрация одного или нескольких реагентов изменяется, то это может повлиять на равновесие между реагентами и продуктами. Повышение концентрации реагентов обычно способствует протеканию прямой реакции, а уменьшение концентрации - обратной реакции.
Температура также оказывает существенное влияние на обратимость реакций. Повышение температуры обычно способствует протеканию эндотермической (поглощающей тепло) реакции, а понижение температуры - экзотермической (выделяющей тепло) реакции. Изменение концентрации на протекание реакции влияет в меньшей степени.
Давление также может влиять на обратимость реакций, хотя этот фактор редко используется в лабораторных условиях. Повышение давления способствует протеканию реакции, в которой суммарное число молекул в газовом состоянии уменьшается. Уменьшение давления, наоборот, способствует протеканию реакции, в которой суммарное число молекул в газовом состоянии увеличивается.
Определение обратимости реакции важно для понимания химических процессов и использования их в практических целях. Знание того, какие физические условия могут повлиять на обратимость реакции, позволяет эффективно управлять процессами и получать нужные продукты в нужных количествах.



