Ковалентная связь – один из основных типов химических связей, определяющих структуру и свойства многих веществ. Она возникает при обмене электронами между атомами, что обеспечивает устойчивость молекулы.
Принцип образования ковалентной связи состоит в том, что атомы стремятся заполнить свою валентную оболочку, то есть обрести определенное количество электронов. Для этого они обменивают электроны с другими атомами, образуя так называемые ковалентные связи.
Ковалентная связь возникает, когда атомы делят электроны друг с другом. В результате этого обмена, электроны обоих атомов заполняют свои внешние оболочки, что делает молекулы более стабильными. При этом, между атомами образуется пара электронов, которые существуют вокруг обоих ядер. Это создает силу притяжения, которая удерживает атомы вместе и образует ковалентную связь.
Ковалентная связь может быть полярной или неполярной, в зависимости от того, как равномерно распределяются электроны между атомами. В полярной ковалентной связи, электроны не равномерно распределены, что создает разность зарядов и образует диполь. Неполярная ковалентная связь, напротив, характеризуется равномерным распределением электронов и отсутствием диполя.
Ковалентная связь является одним из самых прочных типов связей, что делает молекулы стабильными и долговечными. Она также определяет множество свойств веществ, таких как кристаллическая структура, температура плавления и кипения, проводимость электричества и тепла. Изучение принципов образования и взаимодействия атомов в ковалентной связи является неотъемлемой частью химического образования и позволяет лучше понять и предсказывать свойства различных веществ.
Ковалентная связь: что это и как она образуется
Ковалентная связь образуется, когда два атома имеют непарные электроны в валентной оболочке и стремятся достичь более устойчивого состояния. В процессе образования связи, эти атомы делят электроны, создавая общую область с повышенной плотностью электронной оболочки - так называемый "область общей плотности электронов".
В ковалентной связи, каждый из атомов вносит по одному электрону в область общей плотности, образуя тем самым пару электронов, которые удерживаются обоими атомами. Такая пара называется электронной парой связи.
Ковалентная связь может быть одинарной (когда образуется одна электронная пара), двойной (когда образуется две электронные пары) или тройной (когда образуется три электронные пары). Количество электронных пар связи зависит от количества непарных электронов в валентной оболочке атомов.
Образование ковалентной связи может происходить между атомами одного элемента (например, клетчатоводород - H2) или между атомами разных элементов (например, водород и кислород - H2O).
Ковалентные связи обладают высокой прочностью и являются ответственными за структуру и химические свойства молекул. Они образуются по принципу обмена электронами и обеспечивают стабильность и устойчивость атомов в химических соединениях.
Таким образом, ковалентная связь является важным явлением в химии, определяющим структуру и свойства химических соединений, и позволяющим атомам образовывать более устойчивые состояния.
Электронная оболочка и обмен электронами

Чтобы заполнить внешнюю оболочку и достичь стабильности, атомы могут образовывать связи, обмениваясь электронами. Электроны, участвующие в образовании связи, могут быть общими для двух атомов или могут быть полностью переданы от одного атома к другому.
| Общая связь | Полная передача электронов |
|---|---|
| В общей связи атомы делят электроны и каждый атом получает дополнительные электроны от другого атома. Общая связь может быть одинарной, двойной или тройной, в зависимости от количества электронов, которыми обмениваются атомы. | При полной передаче электронов один атом отдает все свои валентные электроны другому атому, атому принимает эти электроны, выстраивая себе полный внешний электронный слой. |
Образование ковалентных связей помогает атомам достичь стабильности и образовать молекулы, в которых атомы совместно владеют электронами. Ковалентные связи имеют важное значение в химии и определяют физические и химические свойства веществ.
Образование пары связанных атомов

Процесс образования пары связанных атомов начинается с того, что один атом предоставляет электронный пары, а другой атом принимает эту пару. Оба атома становятся нейтральными и удовлетворяют октетному правилу – имеют полностью заполненную электронную оболочку. Таким образом, оба атома достигают более стабильного энергетического состояния, образуя между собой ковалентную связь.
Ковалентная связь может быть одиночной, двойной или тройной. В случае одиночной связи, атомы обменивают одну электронную пару, в случае двойной – две пары электронов, а в случае тройной – три пары электронов. Ковалентные связи между атомами могут образовываться в различных комбинациях, обеспечивая разнообразие структур и свойств химических соединений.
Важно отметить, что образование ковалентной связи основывается на принципе равенства и обмена электронов между атомами, что позволяет атомам достичь стабильного энергетического состояния. Ковалентные связи являются основой для образования множества химических соединений и играют важную роль во многих аспектах химии и биологии.
Взаимодействие атомов: обмен и распределение электронов

Для более подробного рассмотрения взаимодействия атомов и обмена электронами, рассмотрим пример ковалентной связи между атомами водорода (H2). В молекуле водорода оба атома водорода обладают по одному электрону в своей валентной оболочке. В процессе образования ковалентной связи, каждый атом водорода отдает один свой электрон, образуя две области с положительным зарядом (ядра атомов водорода) и два электрона образуют две области с отрицательным зарядом (электронные облака).
| Атомы водорода | Ядра атомов водорода (+) | Электронные облака (-) |
|---|---|---|
| H | + | - |
| H | + | - |
Таким образом, оба атома водорода получают по одной доле отрицательного заряда и положительного заряда, что создает электронную плотность между атомами и образует ковалентную связь.
В общем случае, взаимодействие атомов и обмен электронами в ковалентной связи основано на принципе заполнения валентных оболочек атомов. Атомы стремятся достичь наиболее стабильного состояния, заполнив свои валентные оболочки определенным числом электронов. При этом, один атом может отдать электроны, их принимает другой атом, или электроны могут быть общими для обоих атомов.
Полярная и неполярная ковалентная связь
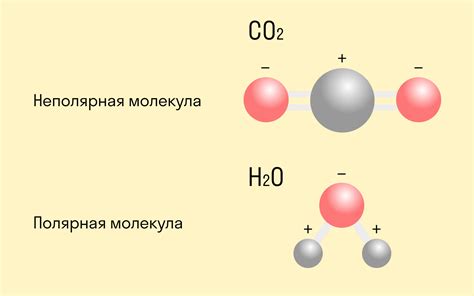
Ковалентная связь возникает при обмене электронами между атомами, что позволяет им образовывать молекулы. В зависимости от разности электроотрицательности атомов, образующих связь, выделяют два типа ковалентной связи: полярную и неполярную.
Полярная ковалентная связь формируется, когда разность электроотрицательности между атомами образующей пары составляет от 0,5 до 1,7. В такой связи один из атомов притягивает электроны сильнее, чем другой, что создает разделение зарядов и формирует полярность молекулы. В результате полярной ковалентной связи возникают дипольные молекулы.
Неполярная ковалентная связь образуется, когда разность электроотрицательности между атомами составляет менее 0,5. В такой связи электроны равномерно распределены и отсутствует разделение зарядов, что делает молекулу неполярной. Примером неполярной ковалентной связи является связь в молекуле кислорода (О2).
Полярность молекулы влияет на ее физические и химические свойства. Полярные молекулы обладают полярными связями, что приводит к образованию межмолекулярных сил ван-дер-Ваальса, диполь-дипольных взаимодействий и водородных связей. Эти силы влияют на плотность, температуру плавления и кипения, растворимость и реакционную способность молекулы.
Неполярные молекулы не образуют полярных связей и не обладают полярными межмолекулярными силами. Они менее поларизуемы и обычно имеют низкую температуру плавления и кипения. Примерами неполярных молекул являются молекула азота (N2) и молекула метана (CH4).
Важно понимать разницу между полярной и неполярной ковалентной связью, так как это помогает объяснить много химических и физических свойств веществ и их взаимодействий в природе.



