Ковалентная связь – один из фундаментальных типов химических связей, в основе которого лежит общий электронный пар, образованный общими электронами между атомами.
Ковалентная связь возникает между атомами, когда они делят свои электроны, чтобы достичь более устойчивого и энергетически выгодного состояния. В результате образуется единый атомный союз, обладающий сильной прочностью и устойчивостью.
Одно из важных свойств ковалентной связи – подразделение электронов. Когда атомы соединяются, электроны <<распределаются>> между ними таким образом, чтобы образовать общие электронные облака. Этот электронный обмен является базовой причиной стабильности и прочности молекул, таких как вода, углекислый газ и ДНК.
Ковалентная связь является основой для понимания многих физических и химических процессов, происходящих в природе. Она определяет химическую активность веществ, их реакционную способность и физические свойства. Открытие и изучение ковалентной связи привело к бурному развитию органической и неорганической химии и синтезу новых материалов с уникальными свойствами.
Ковалентная связь: материальный объединитель атомов

В ковалентной связи образуется пара электронов, которая общими усилиями удерживается двумя ядрами. Ковалентная связь является результатом силы притяжения протонов ядер и электронов, а также отталкивания электронов друг от друга.
Материальный объединитель атомов – именно так можно охарактеризовать ковалентную связь. Пара электронов создает энергетическое пространство, способствующее существованию молекулы. Именно благодаря ковалентной связи атомы могут объединяться в молекулы и образовывать разнообразные химические соединения.
Ковалентная связь играет важную роль в органической химии и является основой для образования органических соединений. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, которые объединены ковалентной связью. Благодаря этому соединению, вода обладает разнообразными свойствами и является одним из самых важных веществ на планете.
Ковалентная связь: характеристики и особенности
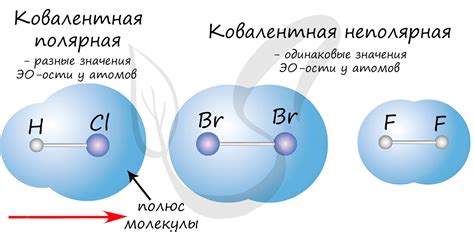
Важной характеристикой ковалентной связи является полярность. Если атомы образуют связь между собой, разность их электроотрицательности влияет на равномерность распределения электронной плотности. Если разность электроотрицательностей большая, связь будет иметь полярный характер.
Ковалентные связи обладают несколькими особенностями:
- Сложность: образование ковалентной связи требует наличия непарных электронов на внешнем уровне энергии у атомов.
- Высокая прочность: ковалентные связи являются довольно крепкими и требуют большого количества энергии для их разрыва.
- Электронная плотность: в ковалентных связях электроны распределяются между атомами и образуют общие электронные облака, создавая стабильность и прочность связи.
- Геометрия молекулы: ковалентная связь определяет форму молекулы. Количество, длина и углы между связями влияют на геометрию молекулы.
- Потенциальная энергия: в ковалентной связи присутствует возможность освобождения или поглощения энергии при ее образовании или разрыве.
Ковалентные связи являются одним из самых распространенных видов связей в химии и обусловливают образование множества молекул и соединений, а также определяют их свойства и реактивность.



