Химия - это удивительная наука, которая изучает строение, свойства и превращения веществ. Один из важных аспектов химии - это определение выпадения осадка. Осадок - это неорганическое соединение, которое образуется при реакции двух растворов между собой.
Определение выпадения осадка играет ключевую роль в химическом анализе и исследовании различных реакций. Это позволяет установить наличие или отсутствие определенного вещества в растворе, выявить химическую реакцию и провести качественный химический анализ.
Для определения выпадения осадка необходимо добавить к раствору реактив, который вызывает образование осадка. Обычно это вещество, которое образует нерастворимые сплавы с ионами вещества, растворенного в растворе.
После добавления реактива можно наблюдать изменения в растворе, такие как образование осадка, изменение цвета или физических свойств. Эти изменения являются первыми признаками выпадения осадка и могут указывать на наличие определенного вещества в растворе.
Важность определения выпадения осадка в химии

Перед началом анализа раствора необходимо определить, есть ли выпадение осадка. Если осадок образуется, это может указывать на присутствие определенного иона или химического соединения в растворе. Это может быть важной информацией при проведении качественного анализа вещества.
Определение выпадения осадка также может быть полезно при определении концентрации определенного вещества в растворе. Если известно, что при определенной концентрации происходит выпадение осадка, то можно измерить количество осадка и определить концентрацию вещества в растворе.
Кроме того, определение выпадения осадка является основой для проведения многих химических реакций и процессов. Например, при осаждении вещества на поверхности материала может происходить формирование пленки или покрытия, что может быть важно в нанотехнологиях и других областях научных исследований.
Таким образом, определение выпадения осадка имеет огромную важность в химии, оно помогает в проведении качественного анализа вещества, определении его концентрации и в многих других химических процессах и реакциях.
Принципы сложения и выделения осадка в химических реакциях

В химических реакциях часто возникает потребность в определении выпадения осадка. Осадок представляет собой твердое вещество, образующееся в результате химической реакции и выделяющееся из раствора в виде нерастворимых веществ. Определение выпадения осадка основано на принципах сложения и выделения осадка.
Основной принцип сложения осадка в химических реакциях состоит в том, что если в реакционной смеси присутствуют ионы, образующие нерастворимые соли, то образуется осадок. Нерастворимость солей зависит от ряда факторов, таких как растворитель, температура, концентрация ионообразующих компонентов. Если растворитель к данной соли не образует раствор, то осадок будет выпадать.
Процедура выделения осадка может быть разделена на несколько этапов:
- Вначале проводится химическая реакция, в результате которой образуются ионы, способные образовывать нерастворимые соли.
- Затем происходит образование осадка в виде твердых частиц, которые выделяются из раствора.
- Осадок отделяется от раствора путем фильтрации или осаждения.
- Выделенный осадок может быть промыт и подвергнут дальнейшему анализу или использован в других химических реакциях.
Определение выпадения осадка может быть полезным инструментом в химическом анализе. Этот метод может быть использован для определения наличия или концентрации определенных ионов в растворе, а также для изучения химических реакций и их механизмов.
| Реакция | Уравнение | Выделение осадка |
|---|---|---|
| Реакция между хлоридом натрия и серебряным нитратом | NaCl + AgNO3 → AgCl + NaNO3 | Выпадение белого осадка хлорида серебра (AgCl) |
| Реакция между хлоридом бария и сульфатом натрия | BaCl2 + Na2SO4 → BaSO4 + 2NaCl | Выпадение белого осадка сульфата бария (BaSO4) |
Использование принципов сложения и выделения осадка позволяет определить наличие или концентрацию определенных ионов в растворах, а также изучить и понять механизмы химических реакций.
Как выбрать правильные реагенты для определения осадка

При выборе реагентов для определения осадка следует учитывать следующие факторы:
- Вещество, которое требуется определить. Различные типы осадков требуют использования разных реагентов. Например, для определения хлоридов можно использовать нитрат серебра (AgNO3), а для определения карбонатов – кислоту хлороводородную (HCl).
- Растворимость реагентов. Реагенты должны быть достаточно растворимыми в выбранном растворителе. Если реагент плохо растворим, это может привести к образованию мелкодисперсных частиц, которые могут быть ошибочно приняты за осадок.
- Образование ярко выраженного осадка. Чтобы убедиться в наличии осадка, реагенты должны образовывать ярко выраженные осадки в процессе химической реакции. Такие осадки, как хлорид серебра (AgCl) или гидроксид железа (Fe(OH)3), обладают высокой степенью видимости и хорошо различимы.
- Селективность реагентов. Реагенты должны быть селективными по отношению к искомому веществу и не реагировать с другими присутствующими веществами. Например, нитрат серебра используется для определения хлоридов, поскольку хлориды образуют не растворимый осадок с серебром, в то время как другие анионы остаются растворимыми.
Правильный выбор реагентов для определения осадка является ключевым шагом в химическом анализе. Важно учитывать специфику искомого вещества, растворимость реагентов, образование ярко выраженного осадка и селективность реагентов. Только при правильном выборе реагентов можно полагаться на точность результатов анализа.
Методы определения осадка в химических реакциях
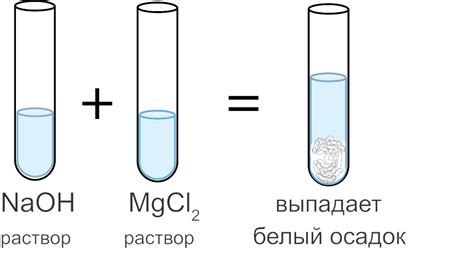
Метод наблюдения: с помощью этого метода можно определить наличие осадка невооруженным глазом. Осадок может быть виден как изменение цвета или мутность раствора. Однако, этот метод не является достаточно точным и не подходит для качественного анализа.
Метод сравнения: данный метод основан на сравнении свойств и характеристик реакционной смеси и исходных веществ до и после реакции. Если после смешивания веществ образуется осадок, то это указывает на наличие осадка в химической реакции.
Метод химических реакций: данный метод основан на проведении химической реакции с известными веществами для обнаружения и идентификации осадка. Например, можно добавить реактив, который будет образовывать осадок при наличии определенного иона в растворе. Если при добавлении реактива образуется осадок, то это свидетельствует о наличии соответствующего иона в растворе.
Выбор метода определения осадка зависит от конкретной задачи и условий исследования. Каждый из предложенных методов имеет свои преимущества и ограничения. Важно учитывать их особенности при выборе метода и интерпретации результатов.
Как правильно наблюдать и фиксировать выпадение осадка
- Подготовьте необходимые реагенты и смесь. Убедитесь, что все реагенты чистые и свежие, чтобы предотвратить возможные искажения результатов.
- Определите оптимальные условия для проведения эксперимента. Это может включать в себя определение правильной температуры, pH или концентрации реагентов.
- Тщательно наблюдайте за процессом выпадения осадка. Обратите внимание на любые изменения цвета, формы или размера осадка. Это могут быть ключевые индикаторы успешного или неудачного эксперимента.
- Фиксируйте результаты наблюдения. Ведите подробные записи о характеристиках осадка, времени, условиях эксперимента и любых других наблюдениях.
- Проведите контрольные опыты. Для проверки надежности результатов повторите эксперимент несколько раз или сравните его с известными данными.
Следуя этим шагам, вы сможете правильно наблюдать и фиксировать выпадение осадка в химии. Это позволит вам получить точные и надежные результаты, которые будут полезны для анализа и интерпретации ваших данных.
Результаты определения выпадения осадка и их анализ
После проведения опыта на определение выпадения осадка в химической реакции были получены следующие результаты:
| Реакция | Вид осадка | Химическое уравнение |
|---|---|---|
| Реакция 1 | Белый осадок | A + B → AB (твердое вещество) |
| Реакция 2 | Желтый осадок | C + D → CD (твердое вещество) |
| Реакция 3 | Коричневый осадок | E + F → EF (твердое вещество) |
- При реакции 1 образуется белый осадок, что указывает на образование твердого вещества AB.
- Реакция 2 приводит к образованию желтого осадка, что говорит о формировании твердого вещества CD.
- После реакции 3 возникает коричневый осадок, что свидетельствует о образовании твердого вещества EF.
Практическое использование определения осадка в химии

В медицине осадки используются для диагностики различных заболеваний. Например, осаждение кристаллов мочевой кислоты в моче может свидетельствовать о наличии патологии мочевыделительной системы.
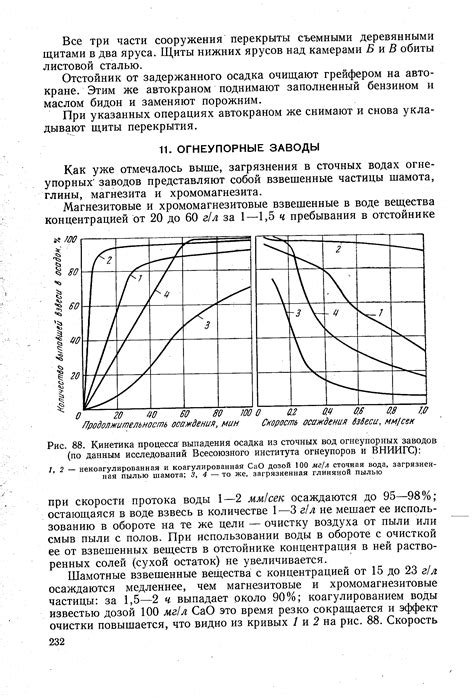
В экологии определение осадка помогает оценить качество воды в реках, озерах и других водоемах. Наличие определенных веществ в осадке может указывать на загрязнение окружающей среды и требовать принятия мер по очистке.
В пищевой промышленности определение осадка используется для контроля качества продуктов. Например, при изготовлении вина осадок, содержащийся в нем, может свидетельствовать о низком качестве или нарушении технологии производства.
Определение осадка также применяется в процессе очистки сточных вод и промышленных отходов. С помощью осадков можно удалять вредные и токсичные вещества из растворов, повышая их чистоту и безопасность для окружающей среды.
В исследовательских целях определение осадка позволяет изучать химические реакции и взаимодействия различных веществ. Эта информация важна для разработки новых материалов, лекарственных препаратов и технологических процессов.
Таким образом, определение осадка в химии играет важную роль во многих областях. Оно позволяет не только проводить качественный анализ различных веществ, но и применять полученные данные для решения практических задач и проблем.



