MgO (оксид магния) – неорганическое соединение, химическая формула которого состоит из атома магния (Mg) и атома кислорода (O). Этот белый кристаллический порошок обладает высокой степенью растворимости в воде и применяется в различных отраслях промышленности. Одним из важных свойств MgO является его способность реагировать с серной кислотой (H2SO4).
Серная кислота – один из самых распространенных и важных химических соединений, которое широко используется в промышленности для производства различных продуктов. При взаимодействии серной кислоты с MgO происходит химическая реакция, в результате которой образуется сульфат магния (MgSO4).
Реакция между MgO и серной кислотой основана на простой замене атомов: один из атомов водорода из серной кислоты замещается атомами магния. При этом образуется нерастворимое соединение – сульфат магния –, которое выпадает в виде белого осадка.
Итак, в результате реакции между MgO и серной кислотой образуется сульфат магния (MgSO4). Эта реакция является важной химической примером и имеет множество применений в различных областях науки и промышленности.
Реакция Mgo с серной кислотой
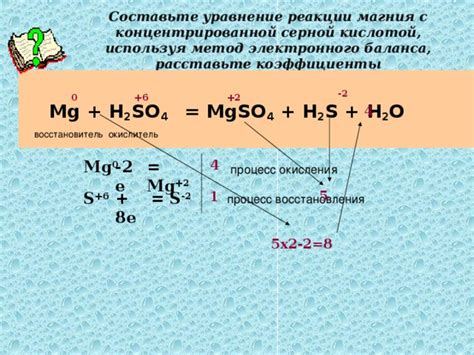
- Mgo + H2SO4 → MgSO4 + H2O
Реакция происходит с выделением тепла и водорода (H2). Сульфат магния (MgSO4) оказывает множество полезных свойств, благодаря которым находит применение в медицине, сельском хозяйстве и других отраслях промышленности.
Процесс реакции между Mgo и H2SO4 может быть наблюдаемым наготовлен через следующие шаги:
- Взять определенное количество Mgo в твердом виде.
- Постепенно добавить серную кислоту к Mgo.
- Наблюдать выделение пузырьков газа и возникновение тепла.
- Полученный продукт может быть отфильтрован и промыт, чтобы удалить избыток серной кислоты и получить чистый сульфат магния.
Реакция Mgo с серной кислотой является важной в химической промышленности и находит широкое применение в множестве процессов производства и исследования.
Химическое взаимодействие

В результате этой реакции образуется сульфат магния (MgSO4) и вода (H2O). Реакция протекает с выделением тепла, что можно наблюдать при растворении магния оксида в серной кислоте.
Химическое взаимодействие между магнием оксидом и серной кислотой обычно иллюстрируют уравнением реакции:
MgO + H2SO4 → MgSO4 + H2O
Эта реакция является классическим примером нейтрализации, при которой кислота и основание взаимодействуют, образуя соль и воду. Магния оксид и серная кислота являются реагентами, а сульфат магния и вода - продуктами реакции.
Такое химическое взаимодействие между основанием и кислотой важно во многих химических процессах и находит применение в промышленности, лабораторных исследованиях и повседневной жизни.
Образование оксидов
Смешивание магниевого оксида (MgO) с серной кислотой (H2SO4) приводит к образованию оксида серы (SO3) и воды (H2O).
| Реагенты | Продукты реакции |
|---|---|
| MgO | SO3 + H2O |
Образование оксидов является важным процессом в химии. В данном случае, реакция между MgO и H2SO4 позволяет сформировать SO3, который может быть использован в других химических процессах или реакциях.
Физические свойства продукта реакции
Магнийсульфат является белым кристаллическим веществом, растворимым в воде. Он обладает горьким вкусом и не имеет запаха.
Магнийсульфат обладает следующими свойствами:
- Растворяется в воде, образуя прозрачный раствор;
- Образует гибкие кристаллы;
- Обладает гигроскопичными свойствами, т.е. притягивает и удерживает влагу из воздуха;
- Выступает в качестве катализатора при некоторых химических реакциях;
- Используется в медицине в виде лекарственных препаратов, например, для лечения обезвоживания организма или как слабительное средство;
- Применяется в сельском хозяйстве в качестве удобрения, так как содержит магний и серу, необходимые растениям.
Таким образом, продукт реакции магния оксида с серной кислотой является полезным веществом с разными физическими свойствами, которые находят применение в различных областях науки и промышленности.



