Оксиды и пероксиды - это два типа химических соединений, которые имеют существенные отличия в своей структуре и способе участия в реакциях. Оба класса соединений содержат кислород, но различаются в количестве атомов кислорода и его окружении другими элементами.
Оксиды представляют собой химические соединения, в которых кислород соединен с другими элементами. Эти соединения имеют общую формулу X2O, где X представляет собой различные элементы. Так, например, оксид кальция (CaO) состоит из одного атома кальция и одного атома кислорода. Оксиды могут быть кислотными или основными, в зависимости от их реакции с водой.
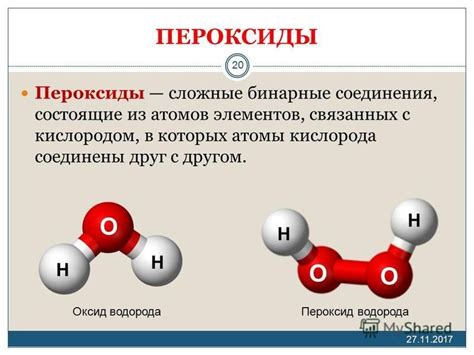
Пероксиды - это химические соединения, в которых кислород присутствует в форме пероксидного иона (O22-). Они имеют формулу XO2, где X символизирует различные элементы. Примером пероксида является пероксид водорода (H2O2), который состоит из двух атомов водорода и двух атомов кислорода в пероксидной форме. Пероксиды обладают более высокой активностью и часто используются как окислители и вещества для отбеливания.
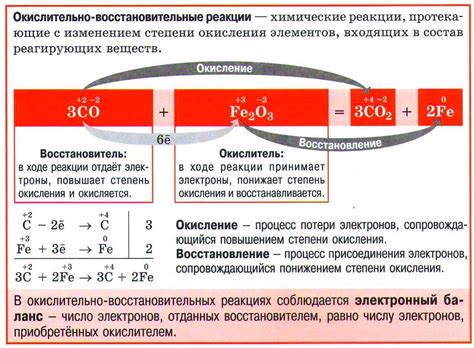
Отличительным свойством оксидов является наличие кислорода, связанного с другими элементами, в то время как пероксиды содержат пероксидный ион O22-. Это отличие в структуре определяет различные свойства оксидов и пероксидов и их реакционную способность. Изучение этих различий важно для понимания реакций, в которых эти соединения участвуют и для широкого спектра промышленных и научных приложений.
Оксиды и пероксиды в химических реакциях
Оксиды и пероксиды представляют собой классы химических соединений, которые часто встречаются в реакциях как окислителей или редукторов. Эти соединения отличаются по своей структуре и активности в химических процессах.
Оксиды состоят из атомов металла, связанных с атомами кислорода. Они обычно имеют простую формулу типа MxOy, где M обозначает металл, а x и y - стехиометрические коэффициенты.
Пероксиды также содержат атомы кислорода, но отличаются наличием атомов кислорода в перекисных связях. Перекисная связь, или связь O-O, делает пероксиды более реакционноспособными по сравнению с оксидами.
Оксиды обычно не обладают свойствами окисления или восстановления, но они могут проявлять кислотные или щелочные свойства в растворе. Некоторые оксиды, такие как оксиды переходных металлов, могут менять свою валентность и обладать каталитическими свойствами.
Пероксиды, с другой стороны, обычно проявляют сильные окислительные свойства и могут быть использованы как источники кислорода в химических реакциях. Они могут быть использованы в перекисных окислениях, при которых происходит передача атомов кислорода на другие вещества.
Таблица ниже показывает некоторые примеры оксидов и пероксидов и их реакции в химических процессах:
| Соединение | Формула | Реакция |
|---|---|---|
| Оксид алюминия | Al2O3 | Реагирует с кислотами, образуя соли и воду. |
| Пероксид водорода | H2O2 | Используется как окислительное средство, благодаря способности передавать атомы кислорода. |
| Оксид углерода | CO | Реагирует с кислородом, образуя диоксид углерода, либо с водородом, образуя монооксид углерода. |
Оксиды и пероксиды играют важную роль во многих химических реакциях, и их различные свойства делают их полезными в различных областях промышленности и науки.
Роль оксидов в химических процессах
Оксиды металлов, такие как оксид железа (Fe2O3), широко используются в производстве стали, применяются в объектах строительства и служат основными катализаторами в различных химических реакциях. Например, Fe2O3 используется как катализатор в процессе производства аммиака.
Оксиды неметаллов, включая оксиды серы (SO2), азота (NO2) и углерода (CO2), играют важную роль в окружающей среде. Оксид серы и оксид азота являются основными составляющими загрязняющих веществ, выделяемых при сжигании топлива, и представляют значительную угрозу для окружающей среды и здоровья человека. С другой стороны, оксид углерода – CO2 – является продуктом сгорания топлива и основным газовым парниковым газом, способствующим изменению климата планеты.
Оксиды также используются в качестве катализаторов в химических процессах. Например, оксид свинца (PbO2) используется в процессе получения хлора и пероксида водорода.
Кроме того, оксиды играют важную роль в процессе ржавления металла, при котором металл окисляется под воздействием кислорода и образуются оксиды металла на его поверхности. Этот процесс является основным механизмом коррозии металлов и может приводить к их разрушению.
Таким образом, оксиды имеют широкий спектр применений и играют важную роль во многих химических процессах, от производства стали до окружающей среды и коррозии металлов.
Уникальные свойства пероксидов

Одно из ключевых свойств пероксидов – их способность окислять другие химические вещества. Это происходит благодаря наличию активного кислорода в молекуле пероксида. При реакции с окисляемым веществом активный кислород переходит на него, а пероксид превращается в простой оксид или другое соединение. Например, в пероксиде водорода (H2O2) активный кислород может окислять органические вещества и превращаться в молекулярный кислород.
Пероксиды также обладают бактерицидными свойствами, то есть они способны уничтожать микроорганизмы. Это связано с их способностью образовывать активный кислород, который наносит повреждение бактериям и вирусам. По этой причине пероксид водорода часто используется как антисептик или дезинфицирующее средство.
Кроме того, пероксиды также являются мощными окислителями. Они могут применяться для выделения кислорода, особенно в химических реакциях, где необходимо удалить его из веществ. Кроме того, пероксиды часто используются в качестве окислителей в различных промышленных процессах, таких как производство бумаги или текстиля.
Сравнение оксидов и пероксидов в химических реакциях
| Оксиды | Пероксиды |
|---|---|
| Содержат один атом кислорода | Содержат два атома кислорода |
| Состоят из одного вещества (металла или неметалла) и кислорода | Можут содержать два одинаковых элемента и кислород, или два разных элемента и кислород |
| Часто выступают в виде твёрдых веществ или газов | Могут быть в различных агрегатных состояниях: твёрдые, жидкие или газообразные |
| Могут быть кислотными, щелочными или нейтральными | Обычно реагируют как окислители или пероксидное вещество |
Оксиды и пероксиды играют важную роль во многих химических реакциях. Их различные свойства и действия позволяют использовать их в различных областях, таких как промышленность, медицина и научные исследования.
Понимание различий между оксидами и пероксидами является важным для практического применения этих соединений и для понимания химических превращений, которые они могут претерпеть. Вместе с тем, их свойства и возможные реакции могут быть использованы для создания новых соединений и материалов с уникальными свойствами и применениями.



