Катализаторы – это важные компоненты химических реакций, которые способны ускорить протекание процессов с низкой энергией активации. Они играют роль активаторов и модификаторов в различных химических процессах и могут быть представлены как веществами, так и высокодисперсными частицами. Столь широкий спектр влияния катализаторов позволяет им использоваться в огромном количестве промышленных и научных областей, от нефтепереработки до синтеза фармацевтических препаратов.
Однако, несмотря на значимость катализаторов, их работа до конца не изучена. Возникает вопрос – насколько верны наши суждения о них? Существуют ли еще неоткрытые свойства или механизмы, которые могут изменить наше представление о катализе? На этот вопрос пытаются ответить многочисленные исследования и эксперименты, которые помогают расширить наши знания в области катализа и тем самым способствуют развитию науки и технологий.
Стремление к пониманию и улучшению катализаторов особенно актуально в условиях современного прогресса. Катализаторы широко применяются в процессах, связанных с экологией, разработкой новых материалов и энергетикой. Эффективность, селективность и устойчивость катализаторов напрямую влияют на результаты данных процессов, и потому совершенствование их свойств является приоритетным направлением в химической исследовательской деятельности.
Факты о катализаторах химических реакций
Катализаторы играют важную роль в химических реакциях, ускоряя их прохождение без изменения самих катализаторов. Вот несколько фактов о катализаторах, которые помогут вам понять их значимость:
| 1. | Катализаторы снижают активационную энергию реакции, что позволяет ей протекать при более низких температурах. |
| 2. | Катализаторы могут увеличить скорость реакции, ускоряя образование промежуточных продуктов и стабилизируя переходные состояния. |
| 3. | Катализаторы могут быть использованы многократно, поскольку они не расходуются во время реакции. |
| 4. | Различные катализаторы могут применяться для одной и той же реакции, выбор катализатора зависит от конкретных условий. |
| 5. | Катализаторы могут действовать как молекулярные "шаблоны", ориентируя молекулы реагентов правильным образом для образования определенных продуктов. |
| 6. | Некоторые реакции могут протекать только при наличии катализатора, поскольку активация реагентов без его участия невозможна. |
Эти факты подчеркивают важность изучения и использования катализаторов в химии. Они позволяют улучшить эффективность химических процессов и снизить их воздействие на окружающую среду.
Роль катализатора в химических процессах
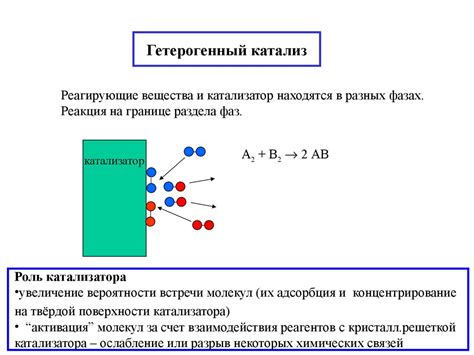
Катализаторы играют важную роль в химических процессах, позволяя ускорить реакцию без изменения самих реагентов. Они действуют, участвуя в реакции, но при этом не расходуются полностью и могут использоваться многократно.
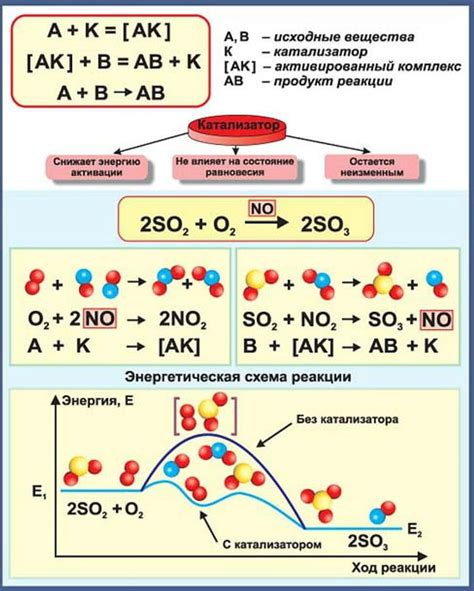
Основная функция катализатора заключается в снижении энергии активации химической реакции. Энергия активации - это минимальная энергия, необходимая для начала химической реакции. Катализаторы увеличивают вероятность столкновения молекул реагентов с достаточной энергией для преодоления барьера энергии активации.
Кроме снижения энергии активации, катализаторы могут изменять механизм реакции, что позволяет увеличить выход продукта или получить продукты с определенными характеристиками.
Катализаторы могут быть различных типов в зависимости от своего состояния, химического состава и механизма действия. Часто используемые типы катализаторов включают металлы, оксиды, ферменты и зеолиты.
Катализаторы также могут быть использованы для улучшения эффективности процессов, снижения степени загрязнения окружающей среды и экономии ресурсов. Они широко применяются в промышленности, производстве пищевых продуктов, фармацевтике и других отраслях.
Важно отметить, что катализаторы сами по себе не принимают участие в химической реакции и не меняют свою концентрацию. Они лишь предоставляют энергетический путь, который позволяет реагентам быстрее и более эффективно взаимодействовать.
Использование катализаторов в химических процессах имеет ряд преимуществ, включая повышение скорости реакции, снижение температуры и давления, повышение степени превращения реагентов и улучшение качества продукта. Катализаторы являются важным инструментом в современной химии, позволяющим проводить реакции более эффективно и экологически безопасно.
Катализаторы: разновидности и функции

Существует несколько разновидностей катализаторов:
Гомогенные катализаторы растворены в реакционной среде и могут быть обнаружены на молекулярном уровне. Они, как правило, представляют собой ионы или комплексы, которые служат инициаторами реакции.
Гетерогенные катализаторы находятся в разделе между фазами и могут быть обнаружены в форме порошков, гранул или покрытий на поверхностях. Их особенностью является способность легко отделиться от реакционной среды и быть регенерированными.
Катализаторы выполняют несколько функций:
- Повышение скорости реакции - катализаторы ускоряют реакцию, снижая необходимую активационную энергию, что позволяет реакции проходить при более низких температурах.
- Улучшение селективности - катализаторы могут направлять реакцию на желаемый продукт, повышая селективность процесса и снижая образование побочных продуктов.
- Повышение стабильности - катализаторы способствуют стабилизации реакционных условий и предотвращают возникновение нежелательных побочных реакций.
- Экономия ресурсов - использование катализаторов позволяет снизить расход реактивов и энергии, что делает процесс более эффективным и экономичным.
Катализаторы являются неотъемлемой частью многих промышленных процессов и имеют важное значение для устойчивого развития человечества. Изучение и разработка новых катализаторов продолжают активно проводиться с целью повышения эффективности и снижения вредного влияния процессов на окружающую среду.
Мифы и правда о влиянии катализаторов на реакции

1. Миф: Катализаторы изменяют исходную химическую реакцию.
Правда: Катализаторы не изменяют исходные реагенты и продукты реакции. Они влияют только на скорость реакции путём снижения активации, т.е. энергетического барьера, что позволяет реакции происходить быстрее.
2. Миф: Катализаторы расходуются в процессе реакции.
Правда: Катализаторы не расходуются в ходе реакции и могут использоваться неоднократно. Они участвуют в реакции, но в результате остаются неизменными и могут быть использованы снова.
3. Миф: Катализаторы всегда положительно влияют на реакцию.
Правда: Не все катализаторы положительно влияют на химические реакции. Некоторые могут привести к обратным реакциям или побочным продуктам. Правильный выбор катализатора играет важную роль в оптимизации реакций.
4. Миф: Катализаторы могут использоваться в любой реакции.
Правда: Катализаторы могут быть специфичными для определенных реакций. Реакции требуют определенных условий и свойств катализатора для эффективного протекания. Неверное использование катализаторов может привести к неудовлетворительным результатам.
| Мифы о катализаторах | Правда о катализаторах |
|---|---|
| Катализаторы изменяют реакцию | Катализаторы влияют только на скорость реакции |
| Катализаторы расходуются в реакции | Катализаторы не расходуются и могут быть использованы повторно |
| Все катализаторы положительно влияют на реакцию | Некоторые катализаторы могут вызывать обратные реакции или побочные продукты |
| Катализаторы могут использоваться в любой реакции | Катализаторы требуют определенных условий и свойств для эффективности |
Как правильно использовать катализаторы

Во-первых, выбор катализатора играет важную роль. Разные реакции требуют разных типов катализаторов, поэтому необходимо провести исследование и определить, какой катализатор подходит для данной реакции.
Во-вторых, необходимо обеспечить правильные условия для работы катализатора. Температура, давление и соотношение реагентов могут влиять на эффективность катализатора. Именно поэтому важно провести предварительное исследование и определить оптимальные условия для реакции.
Третье важное правило - правильное введение катализатора в реакционную смесь. Катализатор нужно добавлять внимательно, чтобы он полностью равномерно распределился в смеси и контактировал со всеми реагентами. Некорректное введение катализатора может привести к его неравномерному распределению и, как следствие, низкой эффективности реакции.
Не менее важно правильно отделить катализатор от конечного продукта реакции. Это может потребовать использования методов, таких как фильтрация или дистилляция. Тщательное изучение и выбор метода отделения помогут достичь максимального выхода продукта и сохранить катализатор для повторного использования.
В конечном итоге, правильное использование катализаторов в химических реакциях способствует повышению эффективности процесса, сокращению времени реакции и снижению затрат. Однако, имеется в виду, что каждая реакция требует индивидуального подхода и определения оптимальных условий для работы катализатора.



